Informații generale despre valența de hidrogen
Hidrogen - gaz incolor, inodor un.
La temperaturi sub -240 ° C (temperatura critică a hidrogenului), este lichefiat sub presiune. Dacă vaporizarea lichidul rezultat, hidrogenul solid se formează sub formă de cristale transparente, care se topește la -259,2 o C.
Hidrogen - cel mai usor dintre gazele, este de 14,5 ori mai ușor decât aerul; în greutate de 1 litru de hidrogen în condiții normale este de 0,09, hidrogenul este solubil în apă este foarte mică, dar în unele metale, cum ar fi nichel, Palade, platină, dizolvat în cantități substanțiale.
Hidrogenul are trei izotopi: H protiu 1, H2 sau deuteriu și tritiu D 3 H sau T. Numerele lor de masă sunt 1, 2 și 3. protiu stabile și deuteriu, tritiu - radioactiv. Miezul 1 H atomi de hidrogen conține un proton. Nuclee includ deuteriu și tritiu, respectiv, cu excepția unui proton singur și doi neutroni.
Molecula de hidrogen este format din doi atomi - H2.
hidrogen valenței în compuși
Nucleul atomului de hidrogen contine un proton, și de o singură orbită în jurul unui electron se mișcă (Fig. 1).
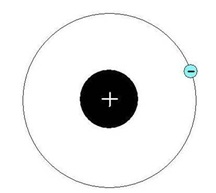
Fig. 1. Structura unui atom de hidrogen.
Formula electronică a unui atom de hidrogen în starea sa la sol este următoarea:
Și diagrama de energie:
Prezența unui electron nepereche indică faptul că hidrogenul este o valență caracteristică egală cu I. Acest fapt este confirmat și de faptul că hidrogenul este în grupa IA din Tabelul Periodic D. Mendeleev, așa cum este bine cunoscut, mai mare valența elementului chimic este determinat de numărul de grup în care se află. Valența hidrogenului este constantă în toți compușii (BAH I 2. H I CI, NaOH I. Ca (H I CO3) 2, etc.)
Exemple de rezolvare a problemelor
Ele pot reacționa unul cu celălalt hidruri binare? Da un răspuns motivat. Ecuațiile posibile reacții la compuși exemplu hidrogen ai elementelor doua și a treia perioade a sistemului periodic.
Compușii cu hidrogen binare de elemente ale perioadelor doilea și al treilea pot interacționa unul cu celălalt, care arată modul în care proprietățile acide bazice și redox. De exemplu, să reacționeze unele cu altele:- Amoniac și apă pentru a forma hidroxid de amoniu (amoniac):
- Amoniac și acid clorhidric (acid fluorhidric) pentru a produce clorură (fluorură) amoniu:
- Fosfină și acid clorhidric pentru a forma clorura de fosfoniu:
În aceste reacții, amoniac și fosfina prezintă proprietățile unei baze și apă, acid clorhidric și acid fluorhidric - proprietăți acizi.
Reacțiile redox apar în interacțiunea dintre litiu și sodiu hidruri cu apă, acid clorhidric și hidrogen sulfurat:
În aceste reacții, hidruri metalice acționează ca un agent de reducere, și apă, acid clorhidric și hidrogen sulfurat - rolul agenților de oxidare.