Procesul de transfer de energie de la un organism la altul fără loc de muncă numit schimb de căldură sau de transfer de căldură. Transferul de căldură are loc între două corpuri cu temperaturi diferite. La stabilirea contactului între corpurile la temperaturi diferite este o porțiune de transfer al energiei interne a corpului la o temperatură mai ridicată la un corp a cărui temperatură este mai mică. Energia transferată în organism, ca urmare a căldurii, numit cantitatea de căldură.
Căldura specifică a unei substanțe:
În cazul în care căldura nu este însoțită de lucrarea bazată pe prima lege a termodinamicii, cantitatea de căldură egală cu variația energiei interne a corpului:

Energia medie a mișcării de translație aleatoare a moleculelor este proporțională cu temperatura absolută. Schimbarea energiei interne a corpului este egală cu suma algebrică a modificărilor energetice ale tuturor atomilor sau moleculelor al căror număr este proporțional cu greutatea corporală, astfel încât schimbarea internă a energiei și, prin urmare, cantitatea proporțională a căldurii cu modificarea masei și a temperaturii:


Factorul de proporționalitate în această ecuație se numește căldura specifică a substanței. Capacitatea termică specifică indică cât de mult din căldura necesară pentru încălzirea materialului 1 la 1 kg K.
Lucrări în termodinamică:
Lucrul mecanic este definit ca produsul modulelor de forță și de deplasare și cosinusul unghiului dintre ele. Munca se face sub acțiunea forțelor asupra corpului în mișcare, și este egală cu variația în energia cinetică.
În termodinamică, mișcarea corpului ca întreg nu este considerat, este o chestiune de părți ale unui organism relativ macroscopică unul cu altul în mișcare. Ca urmare, modificările de volum ale corpului și viteza acestuia este zero. Lucrări în termodinamica se determină în același mod ca și în mecanică, dar nu este o schimbare în energia cinetică a corpului și a energiei sale interne.
La efectuarea lucrărilor (comprimare sau expansiune) modifică energia internă a gazului. Motivul pentru aceasta este, după cum urmează: ciocnirilor elastice ale moleculelor de gaz cu un piston în mișcare schimbă energia cinetică.
Calculăm gazul în timpul operației de expansiune. Actele de gaz de pe pistonul cu o forță
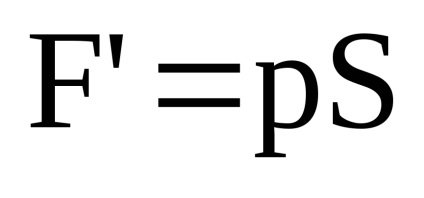




, unde

In timpul expansiunii gazului efectuează muncă, deoarece direcția forței și deplasării coincid. În timpul expansiunii energiei gazelor organelor din jur.
Lucrările efectuate asupra gazului de către organismele externe, diferite de numai gaze de lucru semn




Prima lege a termodinamicii:
Prima lege a termodinamicii este legea de conservare a energiei, comune la fenomene termice. Legea conservării energiei: energia în natură nu apare din nimic și nu dispare: cantitatea de energie întotdeauna, acesta este convertit numai de la o formă la alta.
Corpul considerat termodinamica, centrul de greutate, care este practic neschimbat. Energia mecanică a unor astfel de organisme rămân constante, însă schimbarea poate numai energie internă.
Energia internă poate fi modificată în două moduri: prin transfer de căldură și de lucru al Comisiei. În general, ca schimbarile interne de energie din cauza căldurii, și de a face locul de muncă. Prima lege a termodinamicii este formulat în mod specific pentru astfel de cazuri comune:
Schimbarea în energie internă a sistemului în timpul tranziției de la un stat la altul este egală cu suma forțelor externe și cantitatea de căldură transferată în sistem:

Dacă sistemul este izolat, nu este de peste munca ei se face și nu face schimb de căldură cu organele din jur. Conform primei legi a termodinamicii, energia internă a unui sistem izolat rămâne constantă.
Având în vedere că

Cantitatea de căldură transferată în sistem, există o schimbare în energia sa internă și pentru a face sistemul să funcționeze pe organisme externe.
A doua lege a termodinamicii: imposibil de a transfera căldura de la rece la cald un sistem în absența altor modificări simultane în ambele sisteme sau organisme din jur.