În mecanica cuantică, se dovedește că ecuația Schrödinger este îndeplinită de propria funcție. definit un set de trei parametri întregi - numere cuantice: principale. orbital și magnetic.
Numărul cuantic principal caracterizează distanța dintre electroni din nucleu - raza orbitei determina nivelele de energie ale electronilor din atom, și poate fi orice valoare întreagă de la unitate (= 1, 2, 3, ...). În fizica atomică, stările de electroni care corespunde numărului cuantic principal. (= 1, 2, 3, 4, ...) literele pot fi desemnate
Orbital (azimutală) determină mărimea numărului cuantic al momentului cinetic orbital (moment unghiular) al unui electron într-un câmp simetrie sferică:
și forma de distribuție amplitudine a funcției de undă a electronilor în atom, adică, forma norului de electroni (o forma de orbitali atomici). Subnivel determină nivelul de energie definit de numărul cuantic principal, iar acest lucru poate lua valorile 0, 1, 2, ... 1. Regiunea spațiului în care o mare probabilitate de a găsi un electron (cel puțin 0,95) se numește orbital. Potrivit mecanicii cuantice, nu există nici orbite circulare particulare de electroni, la fel ca în teoria Bohr. În virtutea naturii val al electronului „uns“ în spațiu, ca un „nor“ de sarcină negativă. Numerele cuantice și mărimea și forma norului de electroni, numărul magnetic - orientare nor în spațiu. Principalele tipuri de litere denotă orbitali. . . . ... (de la cuvintele ascuțite, principalul, difuză, fundamentală) .Sostoyanie de electroni,
Numerele caracterizati cuantice numite -state = 0, = 1 - -state = 2 - -state = 3 - -state etc. Valoarea numărului cuantic principal este indicat înainte de numărul de stat simbol cuantic orbital posibil de electroni (orbital):
Vezi din cele două tipuri principale de orbitali (numai ea), (trei dintre ele), în care „răspândit“, a taxei de electroni, este prezentată în Fig.
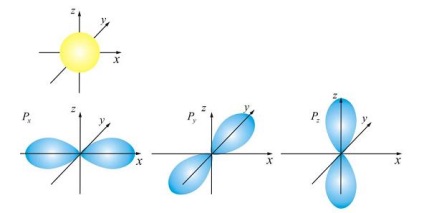
cochilii orbitale numite adesea straturi, deoarece acestea caracterizează forma de orbite diferite, care poate detecta electroni într-un singur strat (pentru un număr cuantic dat).
Numărul cuantic magnetic - numărul cuantic, determină mărimea proiecției momentului cinetic (momentul cinetic) a unui electron într-o direcție predeterminată (axa - direcția câmpului magnetic):
Numărul cuantic magnetic presupune 1 valori întregi februarie (a a), unde - orbital (azimutală) numărul cuantic. Figura arată Impulsul prektsii de puncte la diferite valori ale ratelor (7.5.4) și (7.5.5) indică faptul că momentul electronului și proiecția acestui punct sunt de asemenea valori cuantizate.
Fiecare (în afară) corespunde mai multe valori diferite ale funcțiilor de undă și numere cuantice. Aceasta înseamnă că atomul de hidrogen poate avea aceeași valoare a energiei, fiind în diferite stări. În picioare, cu aceeași energie sunt numite degenerat, iar numărul de stări degenerate cu aceeași valoare energetică se numește degenerării. Fiecare valoare energetică a degenerării
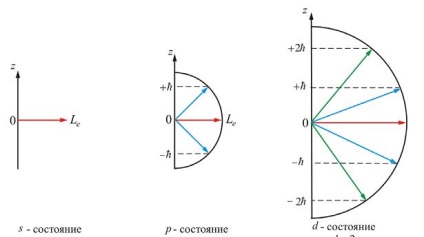
Prezența numărului cuantic magnetic în câmpul magnetic conduce la o divizare a nivelului cu numarul cuantic principal din sub-niveluri, care ar trebui să conducă la divizarea liniilor spectrale. Ramificarea nivelului de energie într-un efect de nazyvetsya Zeeman câmp magnetic.
Despicarea nivelelor de energie în efectul Stark câmp electric nazyvetsya.
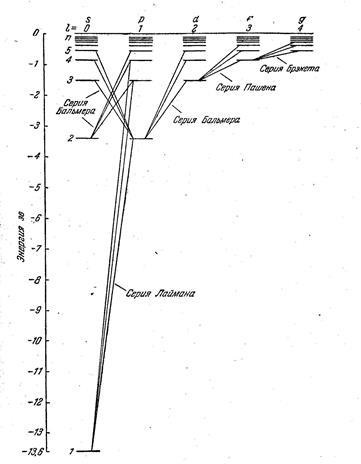
Condiția (7.5.6) se numește regula de selecție, care este o consecință a legii conservării momentului cinetic. Regulile incluse de selecție Lyman corespund următoarelor tranzițiile electronilor în atom de hidrogen: np → 1s (n = 2, 3, ...); Balmer series - tranzițiilor de electroni: np → 2s, ns → 2p, nd → 2p (n = 3, 4, 5, ...); seria Paschen - în cazul în care tranzițiile 4. 5, 6, ...
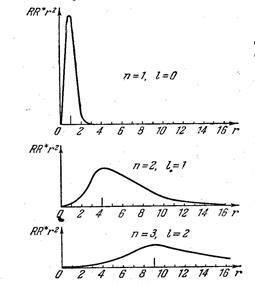
Figura prezintă distribuția densității de probabilitate pentru diferite valori ale numerelor cuantice și (pe unitate de măsură acceptată Bohr raza primei orbite). Probabilitatea de a găsi un electron este diferit de zero pentru orice valori. dar la valori maxime ale razei care coincide cu razele orbitelor definite de teoria Bohr (7.42.16).