Hahanina TI Nikitina NG Grebenkova VI Shutov RF
Laboratorul de lucru practice pe parcursul „Chimie anorganică“ .-
Rezultatele activității de laborator Rata „Inorganic Chemistry“, completată cu exemple de aplicare a proceselor chimice din microelectronica și pentru mediu de evaluare a mediului ecologic. atelier de laborator este recomandat pentru studenții Facultății de etmo specializate în domeniul „Ingineria mediului“, precum și în materialele și procesele de microelectronică.
Nikitina Nina Georgievna,
Grebenkova Valentine losifovna,
Hahanina Tatyana Ivanovna,
Shutov Raisa Frolovna.
Laborator de lucru practice pe parcursul
Fluor, clor, brom, iod, astatin constituie VPA subgrupă au un nivel de configurație externă 2 p 5 ns Astatine preparat în mod artificial, radioactiv timp de înjumătățire
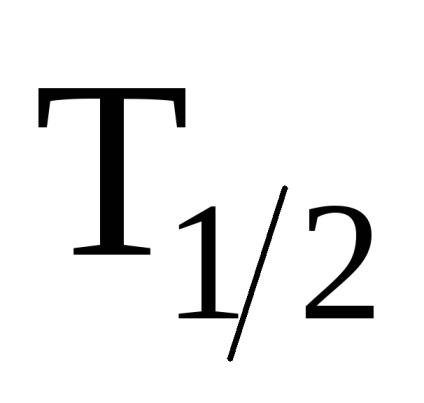
În condiții obișnuite de molecule cu halogen diatomice și există ca T2 (spre deosebire de elementele VIIB subgrupă).
Solubilitatea în solvenți diferite halogeni pot fi o bună ilustrare a regulii „cum ar fi ca se dizolva“. Moleculele halogen nepolare sunt slab solubile în apă și bine - (. benzen, toluen și CC1 al) în solvenți organici nepolari. Bună capacitate de a se dizolva în solvenții organici utilizați pentru extracția din soluții apoase metoda de extracție cu halogen.
halogeni Reactivitate fluor scăderilor de iod. Astfel, fluorul reacționează cu aproape toate elementele de la temperatura camerei (chiar și cu aur și platină), pentru anumite reacții sunt clor numai atunci când sunt încălzite pentru brom, temperatura de reacție trebuie să fie chiar mai mare, iod chiar și în condiții de încălzire puternică reacționează cu un număr limitat de elemente.
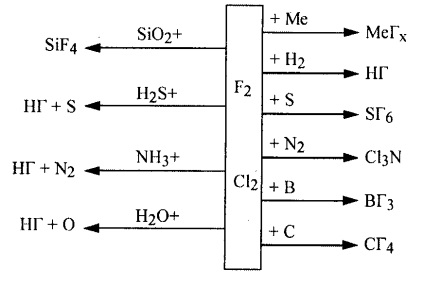
Interacțiunea fluor cel mai activ și clor cu substanțe simple și complexe pot fi reprezentate prin schema:
acid fluorhidric se referă la acizi de tărie medie, pentru că într-o soluție apoasă de ioni de hidrogen în ioni HF2 parțial legat -. Dar bine agent de complexare HF, face parte din mai multe metale și pentru Agenții de decapare semiconductori, sticlă, siliciu, etc. Ion F nu este reducerea .; Cl ion poate fi un agent de reducere în soluții concentrate de acid clorhidric (NaCl nu este agentul reducător) și prin Br F la reducerea creșterii puterii; KI - una dintre cele mai comune agenți de reducere.
Oxigenul Compușii toți halogenii prezintă starea de oxidare pozitiv, altele decât cele de fluor. Astfel, clorul poate fi pozitiv starea de oxidare +1, +3, +5, +7 (tabl.l. 1).
compus clor oxigen
Brom și iod starea de oxidare 7 nu este tipic pentru ei este cea mai stabilă starea de oxidare 5:
Pentru a continua descărcarea aveți nevoie pentru a asambla o imagine: