Structura și proprietățile atomilor. Element de azot N - primul membru al grupului V principal al sistemului periodic. atomii săi sunt conținute în nivelul de energie exterioară cinci electroni. din care trei electroni nepereche (Rețineți regula „8-N»). Rezultă că atomii acestor elemente se pot atașa nivelul de energie trei electroni de finisare exterioare și astfel dobândi starea de oxidare 3, de exemplu, cu hidrogen în compușii - amoniac NH3 și un metal - Li3N nitrură, Mg3N2 și altele.
Atomii de azot pot da, de asemenea, electronii lor exterioare mai multe elemente electronegative (fluor, oxigen) și, astfel, pentru a dobândi starea de oxidare +3 și +5. Atomii de azot prezintă o reducere a proprietăților și în starea de oxidare +1, +2, +4.
Azot - o substanță simplă. Într-o stare liberă, azotul exista ca o molecula diatomica M2. În această moleculă doi atomi N legat foarte puternic triplă legătură covalentă:
puteți defini această relație, și așa:
N = N
Azot - gaz incolor inodor și fără gust. Apa se dizolvă mai puțin oxigen. Concentrația molecula de azot datorită inerției sale chimice.
În condiții obișnuite de azot interacționează numai cu litiu, pentru a forma un Li3N nitrură:
Cu alte metale reacționează numai la temperaturi ridicate.
De asemenea, la temperaturi și presiuni ridicate în prezența unui catalizator, azot reacționează cu hidrogen pentru a forma amoniac:
2N + ZN2 <-> 2NH3
(A se descrie această reacție, echilibrul chimic și ia în considerare condițiile de părtinire la dreapta).
La o temperatură a arcului electric se combină cu oxigenul pentru a forma oxid nitric (II) (caracterizare permit această reacție și ia în considerare, de asemenea, starea de echilibru chimic prejudecată la dreapta).
In natura, azotul este cuprins în principal în atmosferă - 78,09% în volum și 65,6% în greutate. Deasupra fiecare hectar de suprafața pământului continuu „atârnă“ 8 mii. Tone de azot. Din compuși naturali cu azot anorganici, cel mai cunoscut nitrat Nano3 Chile.
Cele mai multe dintre azotul legat conținut în substanțe organice.
Azotul obținut prin distilarea aerului lichid în industria utilizat pentru sinteza amoniacului și acid azotic. Anterior, acest gaz ca mediu inert utilizat pentru umplerea lămpi electrice. In medicina azot pur este utilizat ca mediu inert în tratamentul tuberculozei pulmonare, și azot lichid - în tratamentul bolilor coloanei vertebrale, articulațiilor, etc.
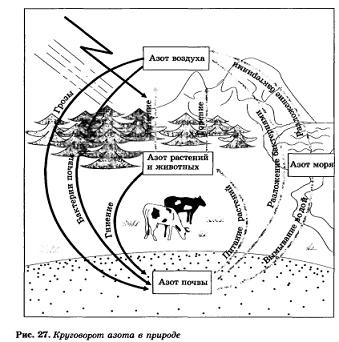
Ciclul azotului în natură. Azot - un element vital. Toate componentele principale ale celulelor de tesut de corp sunt construite din molecule de proteine, care includ azot. Fără proteine nu există nici o viață, și nici o proteină și fără azot. Omul devine proteine din plante și hrana pentru animale, animale, la rândul său, să-i facă, de asemenea, de la plante. Prin urmare, planta - una din sursele de azot de reaprovizionare, care susține viața.
Azotul este o compoziție de proteină vegetală. Animalele obține substanțe proteice gata din plante; în corpul animal conține de la 1 la 10% azot (în greutate) din lână și în coarne - aproximativ 15%. Tot cea mai importantă parte a celulei (citoplasmă, nucleu, shell) sunt construite din molecule proteice.
De o importanță și mai mare sunt bacterii specifice care trăiesc în nodulii rădăcină de leguminoase (trifoi, mazăre, măzăriche, lupin, etc.), acestea sunt numite „nodule“. Aceste bacterii si se leaga de azot-free, adică. E. Este transformată în compuși care metabolizează plantă, formând un corp de proteine.
Compușii cu azot în sol, de asemenea, în timpul realimentat dușuri cu fulgere. După cum știți, este convertit la oxid nitric (IV), în care se formează azot și oxigen de oxid de azot (P), care sub influența oxigenului în aer:
Ultima reacționat cu apă (în prezența oxigenului aer) și se obține acid azotic:
4NO2 + 02 + 2H20 = 4NNO3
Acest acid, obtinerea în sol, reacționează cu acesta: sodiu, calciu, potasiu și formele de săruri - azotat de amoniu, care sunt necesare pentru plante (Figura 27.).
Deschiderea azotului. În 1772, savantul englez D. Rutherford și cercetător suedez K. Scheele a descoperit în experimentele sale privind arderea substanțelor de gaz care nu acceptă respirație și de ardere. Mai târziu, în 1787 G. A. Lavuaze a stabilit prezența gazului în aer, care nu are suport pentru respirație și de ardere, iar la sugestia lui, acest gaz a fost dat numele de „azot“, însemnând „fără viață“ (din latină și -. Nu și Zoe - viață) . Alte nitrogenium nume latin introdus în 1790 Jean Chaptal, înseamnă „dând naștere la nitrat.“
1. Structura atomilor și moleculelor de azot.
2. Proprietăți azot: interacțiunea cu metale, hidrogen, oxigen.
3. Prepararea azotului lichid din aer.
4. Utilizarea azotului.
5. azot în natură și semnificația sa biologică.
Scrierea Ecuații reacții de interacțiune azot cu magneziu, calciu, aluminiu. Luați în considerare aceste procese redox. Cum produsele de reacție? Ce tip de legături chimice în ele și tipul de grilaj de cristal? Ce proprietăți ar trebui să aibă produsele de reacție?
Scrieți reacțiile prin care să efectueze următoarele conversii:
N2 -> Li3N -> NH3 -> N0 -> N02 -> HNO3
Să considerăm mai întâi ca reacție redox.
Se descrie reacția conform diferitelor criterii:
2NO + 02 <-> 2NO2 + Q
Luați în considerare condițiile deplasării echilibrului chimic la dreapta.
Se determină coeficienți în ecuațiile reacțiilor corespunzătoare următoarelor scheme, echilibrul electronic al metodei:
a) NH3 + 02 -> N0 + H20
b) NH3 + 02 -> N2 + H20
In laboratorul de azot obținut prin descompunerea azotit de amoniu:
NH4N02 -> N2 + 2H20
Dacă aveți corecturi sau sugestii la această lecție, vă rugăm să ne contactați.
Dacă doriți să vedeți alte ajustări și sugestii pentru lecții, uita-te aici - Forumul Educațional.