Reacția Hofmann. 1) Conversia amide carboxilice-în amine primare cu eliminarea CO2. se produce sub acțiunea hypohalites metalelor alcaline (Hoffmann rearanjare, Hofmann clivarea amide):
Pentru alcalii p-py hipohalogenit apos amidică adăugat: Seq. încălzire la 40-80 ° C completează p-TION. Pentru a crește randamentul aminelor la amide ale superioare grași p-t-TION este efectuată într-un alcoolic p-D. Uretani astfel formate sunt ușor hidrolizat la amine. Prima etapă de reacție Hoffmann-N-sinteza galogenamida care formează sub influența sarea alcalină instabilă a I:
Etapa viteză definind reacție Hoffmann halogen -otscheplenie pentru a forma nitrenă II, la ING rearanjare stabilizat la izocianat.
Ultima în interacțiune. cu H2O prin-ilcarbamic la convertit. o amină.
Sa constatat că grupul de Migrare salvează configurația. anion Fugitive interacțiunii can amidă III. cu conexiune. conținând electrofil. legături multiple. de ex.
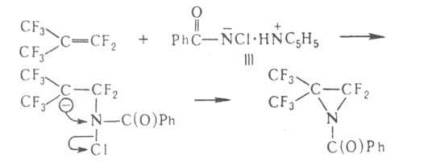
Amidygidroksikislot inenasyschennyh la-t la convertit condiții de reacție Hoffmann. la aldehide. amide ale k propionic substituite în m-nitrili. amidyatsilaminokislot - în atsilglioksalidony:
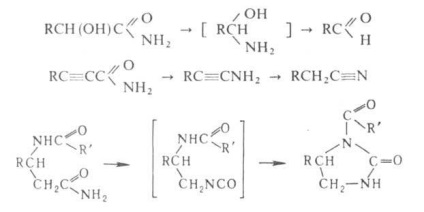
Cu Hoffmann reacție poate fi preparat cu randamente bune alifatich. gras aromatic. aromatic. și geterotsiklich. amine. diamine și aminoacizi; în reacția bal-Hoffmann este folosit STI pentru sinteza pe care să-antranilic.
P-TION este deschis A. V. Gofmanom în 1881.
2) Descompunerea bazei de amoniu cuaternar. având un atom de carbon în lanț N atom vpolozhenii la N, la o amină terțiară. olefină și apă (Hoffman divizare):
De obicei, realizată prin evaporarea unei p-ra tetraalchilamoniu hidroxid apos sau alcoolic (adesea sub vid), cu o creștere treptată a r-ry la 100-150 ° C Folosind un amestec de DMSO anhidru și THF reduce t-py r-TION la temperatura camerei. Dacă atomul N asociat în dec. substituenții alchil, în DOS. olefină formată cu cel mai mic număr de grupe alchil pe legătura dublă (tipic Hoffman), de exemplu.
Alternates priuglerodnom atom. capabile de împerechere și creșterea kislotnostvodoroda (de ex. fenil) facilitează scindarea olefinei. Dacă există legătură multiplă vpolozhenii hidrogen otscheplyaetsyaatom și se produce 1,4-eliminare, de ex.
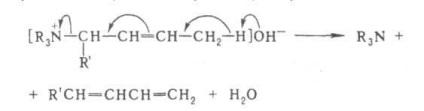
În cazul a două legături conjugate vpolozhenii 1,6-eliminarea se produce și a format trien ex.
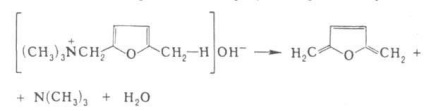
reacția Hoffmann. de obicei, are loc prin mecanismul de eliminare bimolecuă și stereospecificitatea, în anumite cazuri, un ciclic intramoleculară. mecanism, de exemplu.
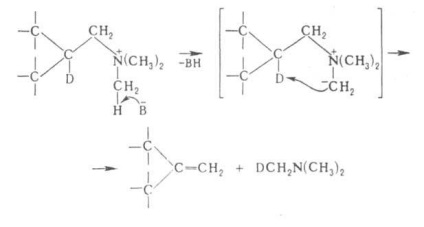
unde B - bazele.
Reacția laterală principală prelucrează la alcooli Hoffmann-formare. și eteri. epoxizi, derivați de THF și ciclopropan. P-TION reacție similară Hoffmann. introduceți sărurile de sulfoniu și fosfoniu, de exemplu.
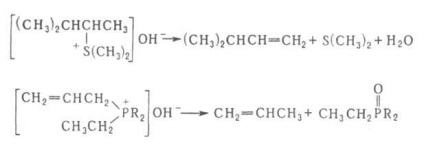
reacția Hofmann utilizat pentru sinteza compușilor nesaturați. Metilarea secvențială a aminelor și scindarea lor (t. Chemat. Metilare exhaustiva) este utilizat pentru a identifica amine.
P-TION este deschis A. V. Gofmanom în 1851.
===
App. Literatura pentru articolul „Hofmann reacție.“ Kop AK Tumbull ER în Sat. Reacții organice. per. din limba engleză. Sat. 11, M. 1965, pp 327-500.; Mal Pass DR în carte. chimia organică totală. per. din limba engleză. vol. 3, M. 1982, p. 68-71. NP Hamparian.