Alcooli. Fenoli. eteri
Înlocuirea unuia sau mai multor atomi de hidrogen din hidrocarburi-les Molek per rezultatele grupei hidroxil în educația moleculei INJ alcool. Alcoolii sunt alifatice, aliciclice și aromatice, iar în ultima grupă-OH nu este legat direct la nucleul aromatic (de exemplu, alcool benzilic C6 H5 CH2OH) Compușii în care gruparea hidroxil este legată la un atom de carbon al inelului aromatic, denumit fenoli.
OH-grup poate fi legat la un atom de carbon primar, secundar sau terțiar. Prin urmare separați în alcooli primari (RCH2OH), secundar (R2 CHOH) și terțiar (R3 COH).
În funcție de numărul de grupe hidroxil de alcooli sunt împărțiți în-un singur atom, dihidric, trihidric etc. Polihidroxilici Speer, vă sunt numite glicoli.
Alifatic (alcooli simpli)
Membrii seriei omoloage de alcooli alifatici au formula generală C n + 1 OH H2N.
alcooli alifatici pot fi reprezentate ca alcani în care un atom de hidrogen este substituit cu o grupare -OH funcțională. De aceea, alcooli denumite alcanoli. Denumirile alcoolilor obținuți din numele aleanul cu up bavleniem sufixul-ol. Mai jos sunt numele primului MEMBRE serii omoloage:
Limita izomerie structurală (alifatici) monoalcooli determinate de structura lanțului de carbon și poziția grupării hidroxil din lanț. De exemplu, există patru izomeri ai butanolului C4 H9 OH. Numerotarea lanțului de la început până la marginea mai aproape de locul unde se află grupul.
alcooli inferiori (până la C12), la temperatura camerei - Yid-os, mai mare - solide. alcooli temperatura de fierbere mult peste alcanilor fierbere cu aceeași masă-mol acous-. De exemplu, t ° a fost încălzit (C2 H5 OH - etanol) = 78 ° C și t ° încălzit (C3 H8 - propan) = 42 ° C; t ° încălzit (C7 H15 OH - heptanol-1) = 180 ° C și t ° încălzit (C8 H18 - octan) = 126 ° C Motivul pentru aceasta este ridicată polaritatea O-H și ușurința de formare a moleculelor de alcool legături de hidrogen. Astfel, alcoolii au anormal de fierbere ridicat tem-peratura datorită legăturilor de hidrogen.
În evaporarea legăturilor de hidrogen lichid între molecule sunt rupte, care necesită costuri suplimentare de energie. În consecință, creșterea greutății moleculare conduce la o creștere a temperaturii de fierbere și alcooli se fierb ramificata la o temperatură mai scăzută, decât neramificat.
alcooli inferiori ușor solubili în apă, ca molecula de alcool formează cu ușurință legături de hidrogen cu moleculele de apă:
Alcooli cu greutate moleculară ridicată și dimensiune mare a formei radical de hidrocarbură (R), este mult mai puțin legături de hidrogen-TION decât moleculele de apă care ocupă același volum ca și molecula de alcool. De aceea, alcooli superiori dizolvare în apă este nefavorabil energetic, iar solubilitatea lor este scăzută.
Formarea amestecurilor azeotrope
Etanolul formează un amestec azeotrop cu apă, care conține etanol 95,6% și cu punct de fierbere la 78,1 ° C Prin urmare, etanol anhidru se poate obține numai prin distilare peste orice drena-lem (de exemplu, CaO - oxid de calciu (II)). Multe alte spiro-vă formează, de asemenea, un azeotrop cu apa.
la reflux lichid perechi de compoziție A are aceeași compoziție ca și lichidul. Aceasta înseamnă că compoziția, și, prin urmare, rata de ratură de fierbere (bp) nu sunt modificate în timpul procesului. Acest amestec se numește azeotrop sau amestec inseparabil de fierbere. Azeotropi - niciun compus, ca compozițiile lor depind de presiunea.
Alcooli ca solvenți
Alcoolii - buni solvenți. Ei se dizolvă atât polar-Nye și substanțele nepolare. Prezența în molecula de polare grupe OH ce le permite să se dizolve substanțele polare, cum ar fi hidroxizii de sodiu și de potasiu. dragul alchil nonpolar de cal furnizează solubilitate în alcooli astfel de compuși cu polaritate scăzută, cum ar fi hidrocarburile.
alcooli alifatici sunt mai ușoare decât apa, iar compușii aromatici - puțin mai greu.
Etanol - lichid mobil cu vâscozitate redusă. alcooli Many-atom din cauza numărului mare de legături de hidrogen au o vâscozitate ridicată.
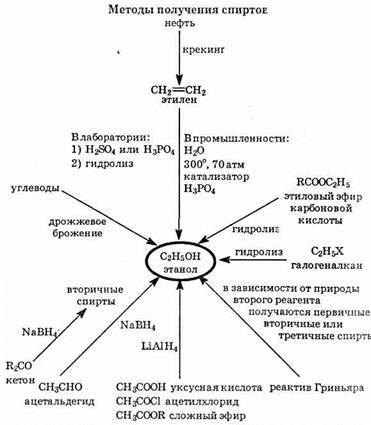
Surse industriale alcooli
1. Hidratarea alchene. Hidratarea catalitică a alchenelor are loc conform mecanismului regulii plus electrofil Markovnikov (vezi. §2.4). De exemplu, prepararea acestui-nol:
2. Gazul natural ca sursă de metanol. Metanolul poate fi semi-pici din gaze naturale. Un amestec de metan cu abur pro lăsat peste catalizator:
3. Sinteza enzimatica de etanol. Etanolul este obținut prin zaharuri bro zhenii, enzime numite de:
Drojdia - un organisme vii unicelulare conținând zimază enzima care catalizează reacția.
sinteze de laborator de alcooli
. Hidroliza haloalcani. Halogenclorură hidrolizate prin soluții apoase de alcalii. Reacția are loc conform mecanismului de substituție nucleofilă:
R-Br + NaOH ®R-OH + NaBr
2. Sinteza alcoolilor din esteri. Când fierberea ester cu un acid diluat sau sub formă alcalină un acid carboxilic sau sare și alcoolul:
Recuperarea de aldehide, cetone și acizi carboxilici. Alcoolii sunt de asemenea formate în reducerea aldehidelor și cetonelor (vezi §6.), Acizi carboxilici și derivații lor - (. Vezi §7) Esterii complexitate-TION și cloruri acide.
Următoarele sunt metodele industriale și de laborator pentru sin-teza alcooli.
Proprietățile chimice ale alcoolilor
La fel ca apa, alcooli prezintă proprietăți amfoteri. alcooli Pain-shinstvo reacții chimice au loc cu ruptura RO-H, de exemplu, reacția cu sodiu sau acid carboxilic
Acizii din cauza ruperii datorate R-OH.
Alcooli - compuși polari. bond Polar -O d - d + H are o ușoară tendință de a disocia de a forma alcoxid Annona și protonul:
În consecință, alcooli - acid slab cu o valoare foarte mică ka »• 10 -16 mol dm -3. în care ka - constanta de disociere-TION. Alcooli - acidul mai slab decât apa.
Prima etapă a acestor reacții este de obicei o protonarea atomului de oxigen. Ulterior legăturii R-O + H2 este rupt mai ușor. De exemplu, reacția de etanol cu lotoy pis iodhidric începe cu transferul de protoni:
Apoi cation alkiloksony pierde o molecula de apa, conv-schayas un halogenoalkane:
Proprietățile de bază sunt cele mai puternice la alcoolii terțiari și se încadrează în terțiar secvenței> secundari> alcooli primari
Proprietățile acide ale alcoolilor în ordine descrescătoare: dumneavoastră primar-VASTE> secundar> alcooli terțiari
Luați în considerare exemplul unei reacții de alcooli de etanol.
reacția de scindare Bond cu RO-H. Proprietățile acide ale alcoolilor
1. Alcoolii reacționează cu Lamy metal alcalin și alcalino, formând astfel un alcoxid metalic și hidrogen. De exemplu, măsurile de etanol reacționează cu sodiu este semnificativ mai lentă decât reacția sodiului cu apă:
Astfel, proprietățile acide ale alcoolilor sunt foarte slabe. Odată cu creșterea lungimii radicalului de hidrocarbură este încetinirea vitezei de reacție.
În prezența alcoxizilor formate de apa se descompun la alcoolul de pornire:
C2 H6 ONa + H2 O®S2 H6 OH + NaOH Se arată că alcoolii - acidul mai slab decât apa.
2. Alcoolii reacționează cu acizii carboxilici, formând astfel esteri. Această reacție se numește zterifikatsii reacție (a se vedea. §7).