O eroare este detectată pe o pagină, selectați-l și apăsați pe Ctrl + Enter
celule electrochimice Concentrația
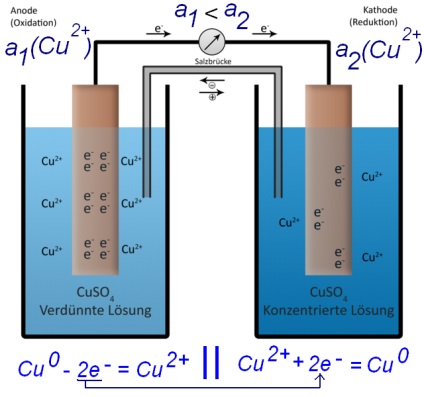
Să ne întoarcem la celula electrochimică „clasic“ este descris în prima parte a articolului. Există două nave. Fiecare din vasele placa de metal este coborâtă în soluția de sare din același metal. Aceste două nave - cu diferite metale - sunt conectate printr-o punte de sare (conductor de ioni), și cele două plăci de diferite metale - conductor electronic (fire). Pentru cupru și zinc, se pare ca acest lucru:
Potențialul unei astfel de celule electrochimice - electromotoare (EMF) este diferența dintre potențialele de cupru și electrod de zinc (Semicelulă)
EMF = E (Cu 2+ / Cu) - E (Zn 2+ / Zn)
Potențialul de cupru și electrod de zinc (Semicelulă), la rândul său, depinde de concentrația de ioni de cupru (zinc) în soluție. În cazul în care concentrația de ioni de cupru (zinc) diferă de standard (1 mol / l), potențialul de electrod se calculează prin ecuația Nernst:
în cazul în care:
E - capacitatea reală a electrodului B;
E 0 - electrod standard de potențial V;
R - constanta universală a gazelor, 8,31 J / (mol · K);
F - Faraday constantă 96485.35 Cl / mol;
T - temperatura absolută în K;
n - numărul de electroni implicați în reacție (în acest caz n = 2 pentru cupru și zinc);
AOX și ARED - concentrație (mai precis - activitate) comburant și un agent reducător.
Dacă înlocuim în valorile Eq R și F (deoarece acestea sunt constante), pentru a lua temperatura la T = 298K (25 ° C) și du-te la logaritmi naturali în zecimal [lg (X) ≈ 0.43429 ln (X)], ecuația Nernst este simplificată:
Zn 2+ + 2e - = Zn 0
Ecuația simplificată în continuare, deoarece în numai oxidant (Zn2 + cation) a soluției, dar nu există nici un reducator (agent de reducere - Zn zinc metalic, este în fază solidă - deci ecuația este exclusă):
Similar cu ecuația arată și electrod de cupru.
Cunoscând concentrația de cupru și zinc în soluție în apropierea electrozilor, putem calcula E (Cu2 + / Cu) și E (Zn 2+ / Zn), apoi - celula forța electromotoare.
Acum, atenția: ce se va întâmpla dacă vom înlocui zinc electrod de cupru în celula noastră electrochimica? - Ie realizand o celulă galvanică a doi electrozi de cupru redus într-o soluție de sare de cupru?
În care potențialul din stânga și din dreapta electrozii de cupru - E1 (Cu 2+ / Cu) și E2 (Cu2 + / Cu); ele pot fi calculate prin ecuația Nernst:
Fără nici calcule arată că, în cazul în care atât concentrația de vase (activitate) a ionilor de cupru - a1 (Cu2 +) și a2 (Cu2 +) sunt egale, vor fi egale și potențialul ambelor electrozii E1 (Cu2 + / Cu) = E2 ( cu 2+ / cu). În consecință EMF curent = 0. Circuitul nu va curge.
În cazul în care concentrația ionilor de cupru în dreapta și vasele rămase vor diferi [a1 (Cu2 +) ≠ a2 (Cu2 +)] - va fi diferit și potențialul dreapta și electrozii din stânga (deoarece potențialul electrodului de cupru este dependentă de concentrația ionilor de cupru în soluție - care este evident din ecuația Nernst).
Prin urmare, EMF ≠ 0 - un curent electric va curge în circuit. Și, deși atât plăcile de cupru au fost aceleași, unul dintre ele va fi dizolvat (în vas, în care concentrația ionilor de cupru este mai mică), iar celălalt - construit (în vas, în care concentrația ionilor de cupru este mai mult). Procesul va merge în sus până când concentrația ionilor de cupru în ambele vase nu sunt egale (sau până când unul dintre electrozii de cupru nu se dizolvă complet).
celule electrochimice Concentrația
Să simplifice ecuația Nernst (temperatura de 25 ° C), având în vedere că cei doi electrozi diferă numai în concentrația (activitatea) a ionilor de cupru în soluție.
Să încercăm să calculeze concentrația de stres a elementului. De exemplu, a2 (Cu2 +) = 1 mol / l și a1 (Cu2 +) = 0,1 mol / l - adică concentrația ionilor de cupru din cele două pahare difera de 10 ori.
EMF = (0,059 / 2) · lg [1 / 0,1] = (0,059 / 2) · 1 = 0,0295 V.
Aproximativ 0,03 V (30 mV) - un pic, dar este foarte posibil să se măsoare tester de tensiune.
Să ne întoarcem la experimentul
Am decis să-l păstrați simplu și au experiență în cilindrul gradat până la 100 ml. Ideea este aceasta: cei doi electrozi de cupru sunt în același vas. dar sunt puse în contact cu diferite concentrații de soluție de sulfat de cupru. Este foarte simplu.
In partea de jos a cilindrului presărat câteva grame de sulfat de cupru, a adăugat apă, scuturat - sare parțial dizolvat. Apa nu a fost în mod evident, suficient pentru a dizolva toate sulfatul de cupru și cea mai mare parte a rămas sub formă de sedimente pe fund. Cilindrul este fixat pe un trepied. Apoi, cu atenție, în porțiuni mici, a fost adăugat la cilindru apă distilată - astfel încât acesta curge în jos pereții cilindrului și amestecat cu o soluție la fund. Se adaugă apa, aproape la început.
O soluție de sulfat de cupru (cu sedimente) a fost în partea de jos, și peste ea - apa. limite clare ca intre ulei si apa, nu au: soluție de albastru lin în apă incolor.
lichid din partea de jos a fost albastru de mai sus - albastru pal, este chiar mai mare - slab albastru. Straturile superioare au fost lichid incolor: culoarea albastră a cationilor de cupru în ele nu a fost vizibil (o soluție foarte diluată de cationi de cupru).
La baza soluției trebuie să fie coborât de sârmă de cupru izolată, în care s-a îndepărtat o porțiune inferioară a izolației cablului - care rezultă din cupru pentru a contacta cristalele de sulfat de cupru, cu soluția saturată, dar nu sunt în contact cu o soluție diluată de sulfat de cupru și o soluție foarte diluată de sulfat de cupru - ca partea de mijloc și de sus a firului a fost izolat.
Acesta este primul nostru electrod al celulei electrochimice: cupru, săruri de cupru a scăzut într-o soluție de concentrație mai mare.
cilindru Top asigurat tub de cupru aplatizata - că este în contact doar cu apă „curată“ (o soluție foarte diluată de cationi de cupru).
Acest al doilea electrod al celulei electrochimice a cuprului nostru, a scăzut într-o soluție de sare de cupru, cu o concentrație mai mică.
Rămâne doar pentru a completa circuitul - se conectează electrozii la bornele testerului.
Dar am făcut un pic diferit: a pus electrozi de cupru în cilindru înainte de reumplut pe partea de sus a soluției de sulfat de cupru, apă distilată, conectate la bornele tester - și apoi reumplut în cilindru în partea superioară a soluției de sulfat de cupru, apă distilată. Când apa a acoperit electrodul superior - lanț se cuplează.
curent electric curgeau. Joasă tensiune: în primele momente - 0.10 la 0.09 V, apoi a scăzut rapid la 0.03-.02 V, dar nu mai este în valoare de ea și speranță (am calculat deja concentrația potențială a elementului cu electrozi de cupru - luat 0,03 in).
Așa că am fost capabili de a construi o celulă de concentrare. Foarte primitiv, dar funcționează.
Dar asta nu e tot: puteți demonstra dependența potențialului nostru element al diferenței concentrațiilor de ioni de cupru in apropiere de electrozi. În acest cilindru gradat concentrația de cationi de cupru scade atunci când se deplasează de la partea inferioară a cilindrului în sus (și foarte inegal - cea mai mare parte sulfat de cupru dizolvat în partea de jos).
In partea de jos este o soluție saturată de sulfat de cupru pe partea de sus - o soluție de sulfat de cupru foarte diluat.
Electrodul superior este fixat un știft (este în contact cu o soluție diluată de ioni de cupru). Inferior electrod - sârmă de cupru izolat, care este doar situată pe partea de jos. Acesta poate fi mutat în sus și în jos (doar foarte atent, astfel încât să nu se amestece soluția!).
Dacă electrodul crește, atunci acesta va fi în contact cu soluția de sulfat de cupru, cu concentrații din ce în ce scăzute - ca urmare a tensiunii celulei electrochimice va scădea (în mod ideal - la 0 V când ar fi în aceeași soluție diluată ca electrodul superior).
Acum, dacă electrodul este coborât treptat în jos (în partea de jos) - diferența de potențial va crește până când se întoarce la valoarea inițială, deoarece electrodul inferior este în contact cu soluția de sulfat de cupru cu o concentrație tot mai mare de Cu 2+ și în cele din urmă, el va fi din nou într-o soluție saturată pe partea de jos.
Teoria - o teorie. Acum - practică. Deoarece tensiunea de noastră a celulei electrochimice este scăzut, comutate milivolți tester scara (1mV = 0,001 V). A trebuit să facem acest lucru o dată, dar este mai bine mai târziu decât niciodată. Indicatii - 22 mV.
Ridicați inferioară superioară electrodului. La limita în cazul în care soluția devine albastru intens ușor albastru - este de 20 mV, iar apoi picătură a mers rapid: în polvysoty cilindru - 6 mV chiar mai mare și 0 mV - tensiune a scăzut la zero, în timp ce electrodul inferior era încă câțiva centimetri sub electrodul superior (fix). Încă mai mare (deja mai sus, în partea inferioară a electrodului superior) și diferența de potențial - minus 1 mV, chiar mai mare - minus 4 mV - electroni merge în direcția opusă!
I omite în jos electrod. Electronii trebuie să înceapă din nou să curgă în aceeași direcție, iar tensiunea - să crească din nou. Dar nu a fost!
Da - direcția actuală sa schimbat în original și, în măsura în care scăderea tensiunii electrodului a început să crească din nou. Dar când ridicarea și coborârea electrodului a relevat o asimetrie puternică tensiune.
Deoarece tensiunea electrodului de scădere a crescut mult mai lent decât înainte de a scăzut în timp ce ridicați electrodul. De exemplu, la jumătate din înălțimea cilindrului era încă tensiune minus 4 mV (electroni curge în sens invers), zero a fost realizată doar la intens soluția albastru și albastru pal (adică, aproape la partea de jos), cu un electrod suplimentar imersat restaurat treptat tensiunea anterioară 23 mV.
De ce a existat o astfel de asimetrie? Unul dintre motive este evident că echilibrul electrodului este realizat nu este instantanee, și, evident, mai lent decât am ridica și coborî electrodul.