Ecuația în acest proces pv - coordonate, are forma p = const, iar graficul procesului (isobars) este reprezentat ca o linie orizontală.
condiția (3.1) rezultă din ecuația și
t. e. raportul dintre căldura specifică egală cu raportul volumelor.
extinderea de lucru a gazului, atunci când p = const în ecuația (3.3) este
A = p (v1 V2-) (3.9)
Folosind ecuația de stare (3.1), putem obține o altă formulă de calcul a muncii A = R (T2-T1).
Prin urmare, semnificația fizică a constantei de gaz, definind-o ca activitatea desfășurată de gaz deoarece 1kg încălzire izobară de 1 grad.
Rezumând cantitatea de căldură dată de ecuația
q = cp (T2-T1) (3.10)
In Ts - coordonează procesul de izobară este reprezentată printr-o curbă logaritmică, dar curba este mai plată în comparație cu isochore (1-2' ).
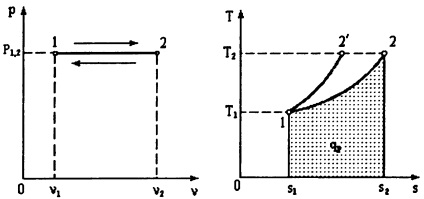
proces izotermic.
Ecuația în acest proces, Ts - coordonatele este T = const, iar graficul procesului (izotermă) este reprezentat ca o linie orizontală.
Din ecuația (3.2) = 0 AU.
Apoi, în conformitate cu prima lege a termodinamicii (3.6) q = A. și anume toate gazele naturale livrate căldura consumată pentru a efectua munca de expansiune.
stat (3.1) Din ecuația rezultă că presiunea și volumul specific sunt invers proporționale între ele. De aceea VPV coordonatele graficului procesului izoterma (izotermă) este o hiperbolă isoscel, pentru care axele de coordonate sunt asymptotes.
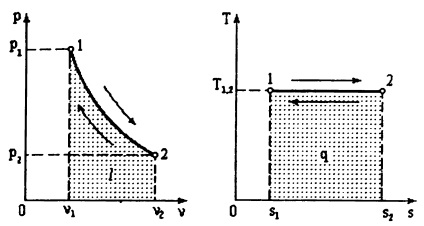
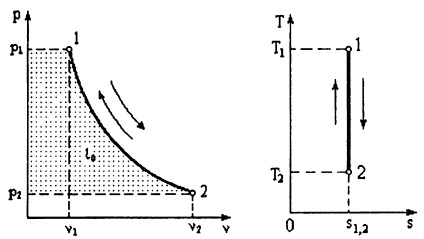
proces adiabatic.
Numitului proces adiabatic în absența schimbului de gaze cu mediul extern dq = 0. Prin definiție ds entropie =, = 0. Atunci ids adică proces adiabatic, în același timp, mai mult și isentropic. proces Program (adiabatică) la Ts - coordonatele este reprezentat printr-o linie verticală.
Conform primei legi a termodinamicii (3.7) = -A AU. și anume munca de expansiune se efectuează numai prin reducerea energiei interne.
Ecuația în acest proces pv - coordonate este PVK = const, (3.11)
unde k = parametru numit indicele adiabatic. Deoarece cp> cv. atunci valoarea lui k> 1. Pe pv de lucru - graficul adiabatică scade mai abruptă comparativ cu izoterma cu creșterea v.
gaze de lucru în procesul adiabatic este definit de prima lege a termodinamicii
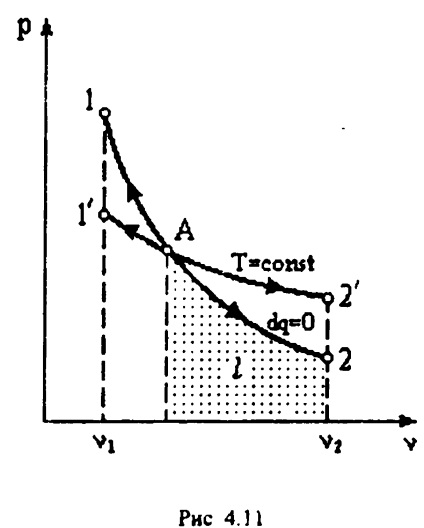
proces politropic.
Chemat un proces politropic, în care căldura specifică a gazului rămâne constantă, adică c = const. Ecuația procesului politropic (politropic):
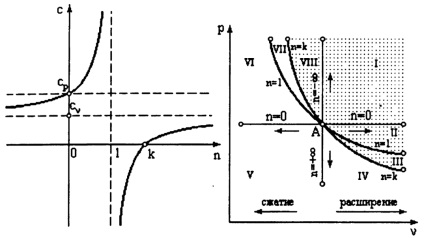
unde coeficientul n = exponent politropice se numește.
Capacitatea de căldură într-un proces c politropic = cv
proces Polytropic este un caz generalizat izoprotsessov toate cele de mai sus:
când n = 0p = const - un proces izobară;
când n = 1pv = const - un proces izoterm;
când n = kpvk = const - un proces adiabatic;
când n = v = const - proces izocoră.