Viteza este întotdeauna mai mare decât zero, prin urmare, în determinarea vitezei printr-un semn de material pus de pornire „-“ .., T la concentrația materiilor prime scade cu timpul.
Rata depinde de concentrațiile de materii prime, temperatura, presiunea (în cazul reacției în fază gazoasă).
Principiul de bază al cinetica chimică - viteza de reacție la fiecare punct în timp este proporțională cu produsul concentrațiilor de materiile prime, construite în unele
grad: r = k [A] a [B] b.
Coeficientul de proporționalitate k se numește constanta vitezei de reacție. Constanta de viteză este numeric egală cu viteza de reacție chimică la o singură concentrație a reactanților.
La rata dimensiune constantă afectează ordinea de reacție. Astfel, pentru prima comanda k = [1 / sec], pentru un al doilea ordin k = [l / mol * s]. Constanta nu depinde de concentrația reactanților, este constantă la o temperatură dată.
Efectul temperaturii asupra constantei de viteză este determinată aproximativ de regula VantGoffa: când temperatura crește la fiecare 10 grade crește rata de reacție
= Γ 10. unde k 2 - constantă la noua temperatură, k 1 - constanta
Temperatura inițială, γ - van't factor Hoff.
curbele cinetice
Curba Kinetic este un grafic al concentrației componentului i-lea
timpii de reacție.
Să ne găsim dependența concentrației în funcție de timp pentru reacțiile 0-3 ordine de mărime. Rata de reacție de ordinul zero, nu se modifică în timp:
Panta unei tangente la orice punct al curbei va fi egală cu viteza de reacție la un moment dat pentru această componentă.
Pentru claritate, curbele cinetice construite în astfel de coordonate, în care curba cinetică devine o linie dreaptă, t. E. liniarizat. Pentru această reacție, circa 1 coordonatele LNC = f (t), pentru aproximativ 2 - 1 / C = f (t).
Ordinea de reacție r = k [A] a [B] b
Particular, reacția este numită ordinea de reacție a componentei i-lea. a - ordinul de reacție pentru componenta a, b - ordinul de reacție pentru componentul b. Ordinea generală a reacției - este valoarea privata: n = a + b.
reacțiile moleculare este numărul de particule care participă la un act elementar de transformare chimică.
Distinge reacție mono-, bi- și trimolecular. Participe la reacție timp de mai mult de trei particule să fie considerată ca o reacție complexă care apar prin mai multe etape elementare, fiecare dintre aceștia fiind mono- trimolecular, biili. Pentru un singur pas reacții omogene simple, molecularity egale cu ordinea reacției.
Timpul de înjumătățire este numit un interval de timp pentru care concentrația inițială a reactanților să scadă cu jumătate.
Fa-ti timp pentru a-și jumătate reacțiile de 0-3 ordine de mărime.
ordinul zero reacție: CA = - kt + C 0 C 2 0 = - kt 1/2 + C 0 t 1/2 = C 2k 0 prim ordin de reacție: CA = C 0 e - kt C 2 0 = C 0 e - kt 1/2 ln 1 februarie = - kt 1/2 t 1/2 = ln2 k
Metode integrale pentru a găsi reacția comenzilor.
1) Metoda de substituție - valorile de substituție obținute timpul și concentrația de materie primă în ecuațiile cinetice ale diferitelor comenzi, descoperim constanta reacției. Ordinea reacției, în care constanta ecuație este constantă pentru toate valorile.
2) Metoda grafică - construct grafice coordonate C - t, LNC - t, 1 / C - t, 1 / C 2 - t. Care dintre aceste grafice va fi o linie dreaptă în această reacție ordine.
3) Procedeu de determinare a jumătății de timp - se efectuează mai multe experimente la diferite concentrații inițiale și de a defini o jumătate de perioade. Prin semiperioadă în funcție de concentrația inițială a determina ordinea de reacție. În acest fel putem calcula ordinea reacției acestei
formula: n = lg t '1' / 2 - t lg '1/2 + 1. cunoașterea perioadelor de înjumătățire la două lg diferite c' '0 - c lg' 0
Concentrațiile inițiale. Ordinea de reacție poate fi fracționată.
4) Metoda Emanuel-Knorre permite calcularea ordinii în formula de reacție:
- gradul de conversie a substanței în momentul
timpul t 't' - punct arbitrar ales în timp, t '' - un punct în timp, la care c '' = (c „) 2.
Metode diferențiale de determinare a ordinii reacției.
AA reacție + bB → Produse.
Viteza de reacție r = -
unde n A. n B - în privat reacții.
Metoda izolației Ostwald. Noi efectua reacția dorită, mai întâi cu un exces de materii prime cu excepția unuia. Apoi putem neglija schimbarea în concentrațiile tuturor reactivilor, în plus, pe care calculul se realizează. Apoi concentrația tuturor componentelor poate adăuga la un coeficient constant, iar viteza de reacție poate fi scrisă ca:
= K 1 c 1 n 1. în care
k 1 n = AKC 20 2
1 n - ordinul reacției primei substanțe.
Logaritm acestei expresii:
ln - r A = ln k 1 + n 1 ln c 1.
Construi un grafic în coordonate ln (-r A) - LNC 1. toate punctele se află pe o linie dreaptă.
Panta acestei linii este egală cu ordinea de reacție a substanței A. Această metodă este determinată prin procedura de concentrare.
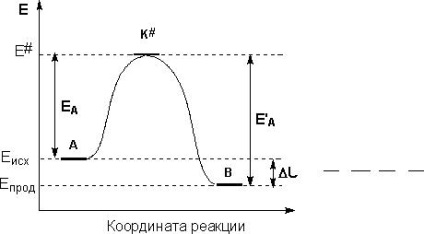
Efectul temperaturii asupra vitezei de reacție chimică
Efectul temperaturii asupra constantei de viteză este determinată aproximativ de regula VantGoffa: când temperatura crește pentru fiecare unitate de viteză 10 grade
factorul pre-exponențial - o constantă numeric egală cu viteza de reacție chimică la temperatura infinită.
Prin trasarea coordonatelor în lnk - 1 / T, obținem o linie dreaptă care intersectează axa verticală a lungimii segmentului lna, și în care tangenta unghiului de înclinare este egal cu E a / R.
Pentru a calcula energia de activare necesară cunoașterea constantelor de viteză la temperaturi diferite, în scopul de a construi grafic.
Ecuația lui Arrhenius permite calcularea constantei de viteză la o anumită temperatură, cunoscând constanta de viteză la temperaturi diferite:
ln k k 1 luna februarie = E Ra (T gerar 1 - T 1 din 2)
Pentru a determina energia de activare în primă aproximație, cele două constantele de viteză suficient pentru a ști când două T. diferite
Coeficientul de temperatură al Van't Hoff poate fi asociat cu o energie de activare:
E a = 0,1 R T T 1 2 γ ln
Pentru a continua descărcarea aveți nevoie pentru a asambla o imagine: