Joining electron atom apare atunci când există un câștig în energie sau cu alte cuvinte, în cazul în care valoarea absolută a energiei potențiale a atomului + electroni crește ca urmare a electronului cu atomul.
Din punctul de vedere al câștigului în energie, formarea legăturii - este un fel de intermediar între procesul de îmbinare a unui electron atomului neutru (afinitate de electroni măsurat) și atașarea electronilor atomului a cărui sarcină miezurilor este crescută cu 1 unitate.
Pentru a evalua energia de legare a moleculelor, constând din multielectron atomi necesare pentru a estima:
- energia de legătură a electronilor de legătură cu nuclee,
- atomi taxa multielectron nucleare,
- energia electron-electron electroni repulsie de legătură din restul electronilor din molecula.
Raportul dintre energia de ionizare și încărcătura nucleului poate fi exprimată după cum urmează (se referă la energia legăturii chimice a unui atom de hidrogen.)
unde EionZ și EionH - este energia de ionizare de la atomul de hidrogen, cum ar fi și un atom cu Z. taxa
În cazul atomilor cu mai multe electroni, valorile de încărcare nucleelor utilizate în calcule nu constituie debitări nuclee ale acestor atomi valabile. În aceste calcule folosesc așa-numitele taxele nucleare efective (sarcini pozitive, care acționează asupra perechii de electroni de legare).
În mod similar ecuația (4.3-1), valoarea energiei de repulsie internuclear necesară pentru a estima energia moleculei poate fi estimată utilizând sarcina nucleară efectivă prin expresia:
în care Erepeff - o energie eficientă repulsie internuclear într-o moleculă formată din doi atomi; ErepH2 - energie repulsie a moleculei H2; Zeff1 și Zeff2 - taxe eficiente prima și a doua nuclee de atomi cu repulsia internuclear.
Am calculat energia unei legături chimice molecule diatomice compuse din atomi și numărul de electroni ca un singur atom de tip de electroni sau atomi de hidrogen cu o sarcină nucleară, egală cu încărcătura efectivă a nucleului acestor molecule.
Pentru a determina schimbarea în energia electronilor în formarea moleculelor din atomii de același tip, ca în cazul moleculei de hidrogen, se scade energia doi atomi din energia moleculară și vom vedea că această energie este egală cu energia legăturii în moleculă.
Acum ne putem întoarce la explicarea energiei de legătură pentru masa Grupa D 4.4. >>
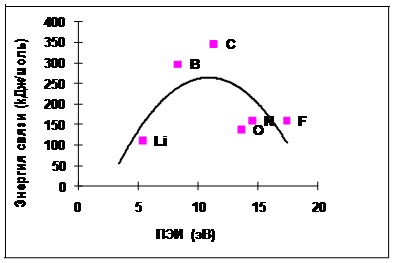
Fig. 4.3-2 Date experimentale privind dependența energiei legăturii chimice în molecula X-X de la X atom PEI pentru elementele a doua perioadă
Fig. 4.3-2 și 4.3-3 prezintă energia de legătură chimică a atomilor PEI care constituie molecula.
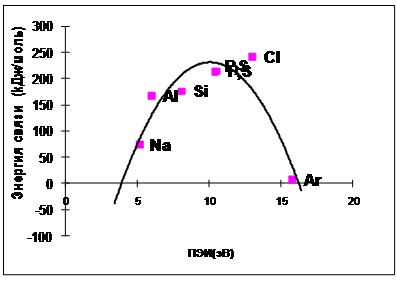
Ris.4.3-3 în molecula X-X de la atom X PEI pentru elementele a treia perioadă a dependenței energetice legături chimice (calculate și datele experimentale).
Sa presupus că energia unei legături chimice și PEI (ambele determinate prin interacțiune electrostatică) corelate. Cu toate acestea, dependența de energie calculată are forma unei parabole. Adică, atunci când PEI este crescut de la 5 la 11 eV [de litiu (Li) la atomul de carbon (C)], mărește energia unei legături chimice, precum și cu creșterea în continuare a PEI cu 11 până la 20 eV scade energia de legare.
Conform datelor experimentale, energia de legare a atomilor este crescut, de asemenea, în intervalul 5 până la 11 eV, dar cu o creștere suplimentară a PEI de 11 până la 16 picături la 0 ° C.
O altă coincidență a dependențelor experimentale și calculate sugerează corectitudinea explicație a naturii legăturii chimice.
energia legăturii chimice