Există mai multe stări de agregare, care sunt toate organismele și substanțele. Acestea sunt:
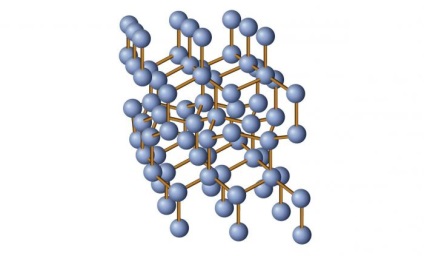
corp cristalin și amorf: concept general
Toate solidele, corpurile, obiectele condiționat împărțite în:
Diferența dintre ele este foarte mare, deoarece la unitățile de bază sunt semne de structură și prezintă proprietăți. Pe scurt, substanța solidă cristalină, și cele menționate ca organism, care au un anumit tip de grilaj spațial, adică au capacitatea de a varia într-o anumită direcție, dar nu în toate (anizotropie).
Dacă vom caracteriza compușii amorfi, primul semn al ei - capacitatea de a schimba caracteristicile fizice în toate direcțiile simultan. Aceasta se numește izotrop.
Structura, proprietățile solidelor cristaline și amorfe sunt cu totul diferite. În cazul în care primele au o structură bine definită, constând din particule aranjate în mod regulat în spațiu, apoi la fiecare a doua este absent.

Proprietățile Solide
Cristalină și amorfă a corpului, cu toate acestea aparțin aceluiași grup de solide și, prin urmare, au toate caracteristicile starea de agregare. Aceasta este proprietățile generale pentru acestea sunt după cum urmează:
- Mecanica - elasticitate, duritate, deformabilitatea.
- Termică - punct de fierbere și punct de topire, coeficient de dilatare termică.
- conductivitate electrică și termică - electrice și magnetice.
Astfel, starea de contact vizualizat posedă toate aceste caracteristici. Doar apar în solide amorfe, ele vor fi oarecum diferită de cea a cristalului.
proprietăți importante pentru scopuri industriale sunt mecanice și electrice. Capacitatea de a recupera după deformare, sau în mod alternativ, fărâmițat și pulverizate - o caracteristică importantă. Este, de asemenea, un rol important jucat de faptul substanța poate conduce curentul electric sau nu este capabil de acest lucru.

structura cristalină
Dacă vom descrie structura solidelor cristaline și amorfe, acesta trebuie să specifice mai întâi tipul de particule care le compun. În acest caz, cristalele pot fi ioni, atomi, ioni de atom (metale), molecule (rare).
În general, structura de date caracterizată prin zăbrele strict ordonate, care formează ca urmare a localizării substanței de particule care formează. În cazul în care structura de cristal prezentă la figurat, va arata ceva de genul: atomi (sau alte particule) sunt plasate unul de altul la anumite distanțe, astfel încât rezultatul să fie o viitoare celulă unitate ideală a rețelei cristaline. Apoi, această celulă se repetă, iar structura de ansamblu astfel format.
Caracteristica principală este că proprietățile fizice ale acestor structuri variază în paralel, dar în toate direcțiile. Acest fenomen se numește anizotropie. Adică, dacă lucrați pe de o parte a cristalului, de cealaltă parte nu poate reacționa la ea. Deci, aveți posibilitatea să taie jumătate o bucată de sare, dar al doilea ar rămâne intacte.
tipuri de cristale
Pentru a desemna două opțiuni de cristale. Primul - o structură cu un singur cristal, adică, atunci când rețeaua în sine 1. cristalin și corpul amorf, în acest caz, este destul de diferit în proprietăți. După cristal unic caracterizat printr-o anizotropie în formă pură. Este o structură foarte mică, elementar.
Dacă cristalele singulare sunt repetate și combinate într-o singură unitate, atunci este o policristalină. Apoi suntem pe anizotropiei întrebării, deoarece orientarea celulelor unitare încalcă structura generală a ordonat. În acest sens, șt corpurile amorfe sunt apropiate unul de altul în proprietăți fizice expuse de.

Metale și aliaje ale acestora
Cristaline și corpurile amorfe sunt foarte apropiate unul de altul. Acest lucru este ușor de văzut luând ca exemplu metalele și aliajele lor. Prin ele însele, ele sunt în condiții normale de solide. Cu toate acestea, la o anumită temperatură, și să înceapă să se topească până la o cristalizare completă, va rămâne într-o stare de întindere în masă, gros, vâscos. Și are deja o stare amorfă a corpului.
Prin urmare, strict vorbind, aproape orice substanță cristalină poate fi amorfă, în anumite condiții. La fel ca acesta din urmă în cristalizarea devine solidă cu o structură spațială ordonată.
Metalele pot avea diferite tipuri de structuri spațiale, cele mai cunoscute și studiate, care sunt următoarele:
- Simplu Cubic.
- Fețe centrate.
- Obemotsentrirovannaya.
Baza structurii cristaline se poate situa prismă sau piramidă, iar partea sa principală este:
- triunghi;
- paralelogram;
- pătrat;
- Hexagon.
Proprietățile ideale are substanță izotropie având o rețea cubică simplu corect.

Conceptul de amorfismul
Cristalină și diferența externă a corpului amorf este destul de simplu. La urma urmei, trecutul poate fi adesea confundat cu lichide vâscoase. In materialul amorf bazat pe structura sunt de asemenea ioni, atomi, molecule. Cu toate acestea, ele nu formează o structură strictă ordonată și, prin urmare, proprietățile lor se modifică în toate direcțiile. Adică, ei sunt izotrop.
Particulele sunt aranjate în mod aleatoriu, în mod aleatoriu. Numai uneori, ele pot forma loci mici, care încă nu afectează proprietățile globale prezintă.
Proprietăți organisme similare
Acestea sunt identice cu cele ale cristalelor. Singura diferență de performanță pentru fiecare organism în parte. De exemplu, este posibil să se selecteze astfel de parametri caracteristici solide amorfe:
- fermitate;
- densitate;
- viscozitate;
- ductilitate;
- conductivitate și semiconductivity.
Puteți găsi de multe ori starea limită de conexiuni. Cristalină și amorfă a corpului poate fi transformată într-o stare semi-amorfă.
De asemenea, interesant este caracteristica statului în cauză, care se manifestă într-o influențe externe ascuțite. Astfel, în cazul în care organismul amorf pentru a expune un șoc ascuțit sau deformare, acesta este capabil să se comporte ca un policristalină și împărțită în bucăți mici. Cu toate acestea, dacă vă dau aceste părți de timp, în curând se unesc din nou împreună și du-te în stare fluidă vâscos.

În această stare de conectare nu este sigur de temperatură la care are loc tranziția de fază. Acest proces este foarte extins, uneori zeci de ani (de exemplu, descompunerea polietilenă de înaltă densitate).
Exemple de materiale amorfe
Există mai multe exemple de astfel de substanțe. Notăm unele dintre cele mai vizibile și mai frecvent întâlnite.
- Ciocolata - un amorf tipic.
- Rășini, inclusiv fenol, toate materialele plastice.
- Amber.
- Sticla de orice compoziție.
- Bitum.
- Tar.
- Ceară și altele.
corp amorfa este format de o cristalizare foarte lentă, adică creșterea vâscozității soluției la temperatură scăzută. Este adesea dificil să numim astfel de substanțe solide, acestea sunt denumite lichid gros mai vâscos.
stare specială sunt acei compuși care la solidificare nu cristalizează. Ele se numesc ferestre, iar starea - sticloasă.
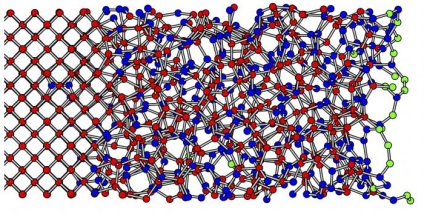
substanță sticloasă
Proprietățile corpurilor cristaline și amorfe sunt similare, așa cum am descoperit, din cauza originii comune și o natură interioară comună. Dar, uneori, le consideră stat separat specială a materiei, numită corpul vitros. Această soluție omogenă mineral care cristalizează și se solidifică fără să formeze Grile spațiale. Aceasta este în continuare pentru a schimba proprietățile izotrope întotdeauna.
De exemplu, fereastra de sticlă obișnuită nu este valoarea exactă a temperaturii de topire. Este ușor de a crește acest indicator se topește încet, se înmoaie și devine lichid. În cazul în care impactul de oprire, care va inversa procesul și să înceapă solidifying, fără cristalizare.
Astfel de materiale sunt foarte mult apreciate, sticla de azi - una dintre cele mai comune și populare materiale de constructii din lume.