Conformația Termenul aplicat proteinelor utilizate pentru a descrie aranjament spațial (în toate sau porțiuni selectate) ale lanțului polipeptidic, capabilă să schimbe poziția în spațiu, fără a rupe schelet covalente datorită rotației libere în jurul legături carbon-carbon.
Structura secundară - un aranjament spațial ordonat (conformație) a porțiunilor individuale ale lanțului polipeptidic. Acesta este format prin circuitul de legături de hidrogen între grupurile de peptide, adică, imino între hidrogen și oxigen al grupării carbonil. Structura secundară este structuri regulate, cum ar fi o spirală, straturi pliate b, b-îndoi. O parte a lanțului polipeptidic are o structură ordonată, astfel de zone sunt numite regiuni amorfe sau nestructurate. Unul sau alt tip de structură secundară este determinată de structura primară a acestei porțiuni de lanț polipeptidic și este termodinamic cea mai favorabilă pentru condiții biologice date.
o-helix se caracterizează printr-un ambalaj extrem de densă a lanțului polipeptidic. Strâns ondulate forme cu lanț de polipeptide creasta o tijă. Radicali resturile de aminoacizi sunt rotite spre exterior și sunt dispuse pe laturile opuse ale axei (Figura 1.1).
Radicalii resturi nepolare grupate, de obicei, pe de o parte a unei helix, formând un arc nepolare: aceasta creează condițiile pentru convergența diferitelor regiuni elicoidale. Proteinele naturale exista doar pravozakruchennye un helix, care este cauzată de prezența aminoacizilor din proteine sunt L-series.
a-helix este stabilizat prin legături de hidrogen între oxigen care apar grupe carbonil și grupele imino hidrogen situate pe spirelor adiacente ale helixului. Fiecare grupă carbonil formează o legătură de hidrogen cu al patrulea grup NH- în aval. Legăturile de hidrogen a-helix sunt toate aproximativ paralel cu axa helix. Să promoveze formarea unui helix KLH, ALA, LEU. Cota de site-uri spiralized în proteine este diferit. Astfel, lanțurile polipeptidice ale mioglobinei cu 80% este reprezentat sub forma unei helix in insulina spiralized doar 50% din lanțuri, chimotripsina nu le conține deloc
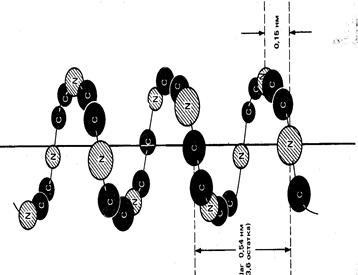
Figura 1.1 Plot structurilor de proteine a helicoidal
b-structura. L.Poling deschis și Corey o altă formă de realizare a structurii periodice, care au numit straturi pliate b. Această variantă de realizare este caracterizat prin structura secundară. care are o formă de tijă plată, mai degrabă decât. Lanțul polipeptidic se pliază b-aproape complet extins și nu răsucite strâns într-un helix. porțiuni cutate PPV tind să rămână aproape de molecula de proteine pentru a forma un straturi sau benzi pliate.
Cele mai multe dintre structurile pliate conțin mai puțin de 6 straturi. secțiunile adiacente pliate în strat TST poate avea același vector (paralel b-strat), sau pentru a merge în direcții opuse (antiparalel b-strat). Radicali ale resturilor de aminoacizi sunt perpendiculare pe planul stratului, în care acești radicali sunt orientate pe unul și apoi pe cealaltă parte a acestui plan. Formarea b-structură este facilitată de exemplu un aminoacid MET, VAL, GLY, PRO.
b-îndoire - acesta este PPTS turn de 180 de grade. Acesta este format prin legături de hidrogen, ca rezultat al interacțiunii dintre oxigen al grupării carbonil a unui rest și hidrogenul din grupa imino altui rest de aminoacid. proteine globulare au o conformație globular compactă datorită faptului că PPC are o mulțime de b-răsturnări de situație. Formarea b Derivatii contribuie la resturile de prolină.
Amorfi (regiuni, dezordonate non-structurate) sunt zone PPV caracterizate structură neregulată, care se păstrează de legături de hidrogen.
Structura Supervtorichnaya. o și porțiuni structurale b elicoidale în proteine pot interacționa între ele și unele cu altele, formând ansambluri. Structura spațială a acestor ansambluri numita structură secundară super- sau structura supervtorichnoy. De exemplu, - supercoiled a-helix, în care două un helix este înfășurat pe un altul.
Domenii. Ele sunt structural și funcțional regiune separată a moleculei, conectate între ele prin porțiuni scurte ale lanțului polipeptidic, care sunt numite porțiuni balama.
Structura terțiară caracterizează dispunerea spațială și zonele amorfe ordonate în general PPV, adică descrie ambalarea spațială (conformație) a întregii molecule de proteină, în cazul în care este prezentat un PPV. Structura terțiară datorită convergență și de reacție, reziduurile radicalilor mai distanțate în secvența liniară a PPV.
proteine globulare sunt caracterizate de PPV ambalare compact. Astfel, radicalii resturi nepolare aminoacizi având afinitate pentru apă, localizate în principal în interiorul Globula și forma una sau mai multe regiuni hidrofobe (nuclee) la centrul globulelor proteice. Cei mai radicali polari prezenți pe suprafața globulelor în stare hidratată și orientat spre mediul apos. Pe suprafața globulelor poate fi, de asemenea, o cantitate mică de radicali nepolare, în cazul în care acestea sunt acumulează pentru a forma un cluster hidrofobe sau zone „lipicioase“. Astfel, suprafața totală a globulelor mozaic proteic: în esență hidrofil, dar conține și porțiuni nepolari.
Stabilizeaza structura terțiară următoarele link-uri:
1 legături covalente (disulfit)
a) legături hidrofobe
b) legături de hidrogen
1. Legătura bisulfura (bisulfura punte), formată prin interacțiunea dintre radicalii grupe (oxidare) SH cis în același lanț polipeptidic (intralanț disulfurică) sau între diferite lanțuri de polipeptide (intercatenare disulfurică).
necovalente, molecule proteice SPECIFICE.
1. interacțiunea hidrofobă între spațiate strâns hidrofobe resturile de radicali (nepolar) aminoacizi (Ala, Val, Leu, lle, trei, uscator de par, pro, gli, met). (Figura 1.2)
2. Sarea sau legături ionice apar între radicalii laterale ale resturilor de aminoacizi care au sarcini opuse datorită disocierii grupării carboxil și protonarea grupărilor amino. Deoarece de bază (încărcate pozitiv) Grupurile pot acționa ca grupa e-amino a Lys, gruparea guanidino Arg, un GIS grup imidazol (unul din atomii de azot ai grupării imidazol are proprietăți de bază, altele - acide). Adăugarea de histidină ca un acid (grupuri încărcate negativ) efectuarea grupări carboxil libere Asp și Glu.
Conformația nativă a statului în cea mai favorabilă energetic. Structura terțiară determinată de structura primară a PPV, astfel putem vorbi despre determinismul genetic al structurii terțiare.
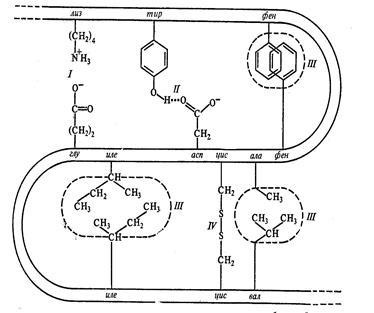
Fig. 1.2 Comunicarea stabilizarea structurii terțiare a proteinei. I - obligațiuni ionice II - legătură de hidrogen, III - legături hidrofobe, UI - legătură disulfidică.
struktu cuaternară descrie orientarea relativă a două sau mai multe PPTs moleculă de proteină sintetizată în mod independent. Proteinele cu oligomeri cuaternare structura numite și lanțurile polipeptidice constitutive - protomers sau subunități. Subunitățile ale proteinei oligomerice pot fi identici sau diferiți. Ei au o literă de unitate, cel mai adesea în oligomeri include un număr par de protomers. Structura cuaternară depinde de structurile primare, secundare și terțiare ale subunităților sale constitutive. Formarea structurii cuaternare a tipului de auto-asamblare are loc fără implicarea enzimelor.
Structura cuaternară este stabilizată în mare măsură prin legături hidrofobe, datorită prezenței pe suprafața subunitățile hidrofobe zone „lipicioase“. Proteinele cu structura cuaternară sunt hemoglobină (patru subunități), imunoglobuline (două lanțuri ușoare și două lanțuri grele), proteina miozina contractile (grele și 2 lanțuri ușoare 4). Enzimele sunt structura cuaternară operează cu anumite funcții de reglementare.
Prezența unui număr mare de diferite proteine oligomere în interiorul celulelor reduce osmolalitatea și vâscozitatea în aceasta. Proteinele oligomere sunt bine reglementate prin diverse efectori. Semnificația biologică a proteinelor oligomerice este de asemenea asociat cu faptul că codificarea lor genetică necesită mai puțin material, în cazul în care unele sau toate moleculele de subunitate sunt identice. Noi oligomeric proteine, este mai puțin probabil de molecule defecte.