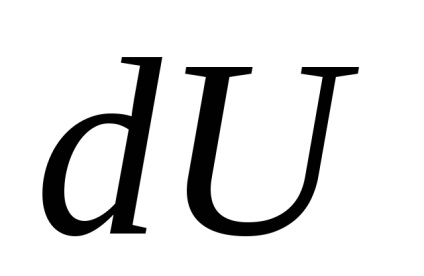sistem termodinamic în ceea ce privește capacitatea sa de a accepta (sau da) energie sub formă de căldură este de obicei caracterizat prin căldură.
caldura corpului (sistem) este o mărime fizică care este numeric egală cu cantitatea de căldură care trebuie raportată la corpul (sistem) pentru a schimba temperatura sa de un Kelvin.
În cazul în care organismul a raportat Q cantitate infima de căldură. provocând creșterea infinit mici în dT temperaturii, capacitatea sa de căldură C este prin definiție egală
Unitatea de capacitate termică în SI - jouli împărțit la kelvin (J / K).
Experimentarea și calcule teoretice arată că capacitatea termică a corpului depinde de compoziția sa chimică, greutatea și starea termodinamică (de exemplu, temperatura) precum și tipul de schimbare în starea de corp a procesului, atunci când mesajul pentru căldură.
Capacitatea termică specifică este numită capacitatea calorică a unei unități de masă de substanță, adică pentru o substanță omogenă
unde c - căldura specifică, M - masa substanței.
Unitatea de căldură specific în SI - Joule împărțit la kilogram kelvin [(J. /(K.kg)].
Capacitatea termică Molar se numește capacitate termică per mol de substanță, adică
unde S - căldura molară; - masa molară a substanței.
Unitatea de capacitate termică molară SI - jouli împărțită mol Kelvin [J /(K.mol)].
Q cantitate elementară de căldură necesară pentru schimbări în dT temperaturii corpului. Acesta este definit ca
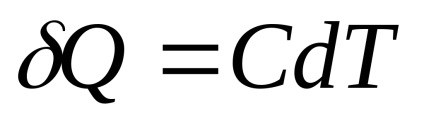
și pentru un corp omogen
unde M / - cantitatea de substanță (număr de moli).
§26. Prima lege a termodinamicii
Prima lege (primul principiu) termodinamica este o expresie matematică a legii conservării și transformării energiei aplicată sistemului termodinamic. Sa stabilit ca rezultat al cercetărilor experimentale și teoretice în fizică și chimie, etapa finală care a fost descoperirea echivalenței de căldură și de muncă, adică, descoperirea că transformarea căldurii în muncă și munca în căldură se realizează întotdeauna în același raport cantitativ strict constant .
În §24 a fost subliniat faptul că energia internă a sistemului poate fi modificat în două moduri: performanța de muncă și de transfer de căldură. Prin urmare, putem scrie:
U12- în cazul în care variația energiei interne a sistemului în timpul tranziției de la starea 1 la starea 2, ca urmare a activității pe ea
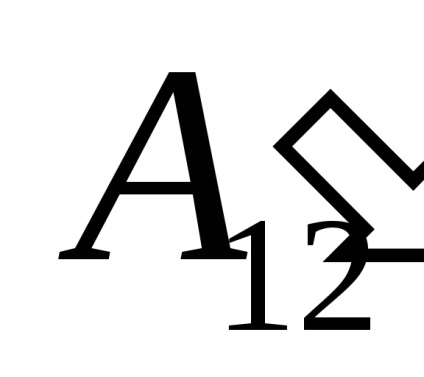

Noi luăm în considerare faptul că activitatea


Prin urmare, expresia (26.1) poate fi rescrisă ca
Această ecuație este o înregistrare matematică a primei legi a termodinamicii: cantitatea de căldură transmisă la sistemul este consumat într-o schimbare a energiei sale interne, precum și pentru a efectua lucrările privind sistemul de organisme externe.
Atunci când o schimbare infinitezimal în ecuația de stare a sistemului (26.3) ia forma
unde