Energia și forța corespunde definiției unității de energie de tensiune superficială și de măsurare de putere. Unitatea de energie este J / m 2. Putere - N / m. Energia și expresia putere echivalentă, iar valoarea numerică este aceeași în ambele dimensiuni. Astfel, pentru apă la 293 K:
O dimensiune este ușor de dedus din celălalt:
SI: J / m 2 = H # 8729; m / m2 = n / m;
Efectul diferiților factori asupra
Influenta naturii chimice a substanței
Tensiunea superficială - munca cheltuită pentru a rupe legăturile intermoleculare. Prin urmare, cu cât legăturile intermoleculare în organism, cu atât mai mare tensiunea superficială la interfața cu faza gazoasă. În consecință, tensiunea superficială este mai mică la lichide nepolare având un legături intermoleculare slabe, și mai mult în lichide polare. Are o substanță de tensiune superficială mare având legături de hidrogen intermoleculare, de exemplu apa.
Valorile tensiunii de suprafață și de energie de suprafață în substanțe specifice în limita aerului
* - prezintă valorile de energie de suprafață specifică
Cu creșterea temperaturii, distanța dintre moleculele crește odată cu creșterea temperaturii tensiunii superficiale a fluidelor individuale este redusă, adică relația:
Pentru dependența multe fluide # 963; = f (T) este de aproximativ liniară. Extrapolarea dependența liniară a axei x definește TC temperatură critică a substanței. La această temperatură, sistemul cu două faze de lichid - vapori de încetează să mai existe și devine o singură fază.
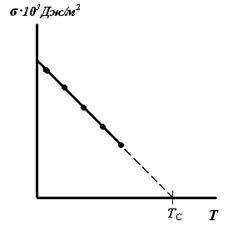
Pentru majoritatea lichidelor nepolare dependența de tensiune superficială de temperatură este exprimată prin ecuația :. (9.5) unde # 963, T - tensiunea superficială la orice temperatură, # 963; 0 - o tensiune superficială la temperatură standard, # 916, T - diferența între aceasta și o temperatură standard, # 945; - coeficientul de temperatură al tensiunii de suprafață (9.6)
Pentru multe substanțe, coeficienții de temperatură ale tensiunii de suprafață sunt de la aproximativ -0.1--0.2 mJ / (m 2 K).
Influența naturii invecineaza fazelor
Tensiunea de suprafață (# 963; 12), la limita a două fluide 1 și 2 depinde de natura chimică (polaritate). Cu cât mai mare diferența în lichide polare, cu atât tensiunea superficială la interfața lor (de obicei Rebinder).
Cantitativ, tensiunea interfacială între două lichide saturate reciproc poate fi calculată din regula aproximativa Antonov.
Antonov Rule (1907): Dacă lichidul este limitat solubil unul în celălalt, tensiunea superficială la interfața x1 / x2 este egal cu diferența dintre tensiunile superficiale sunt saturate reciproc lichide la interfața lor cu aer sau cu propria lor abur:
Umezirea - reacția unui lichid cu un solid sau un alt corp de lichid în prezența contactului simultan trei faze nemiscibile, dintre care unul este în general un gaz (aer).
Atunci când se aplică o cantitate mică de lichid pe suprafața solidă sau suprafața altui lichid având o densitate mai mare, două cazuri: în primul caz, ia forma de picături de lichid, curge în celălalt caz. Luați în considerare atunci când primul proces picătura nu se răspândește pe suprafața unui alt corp.
Ris.9.3.Smachvanie la interfața de trei faze
Luați în considerare o picătură de lichid pe o suprafață solidă în condițiile de echilibru. Deoarece tensiunea superficială poate fi considerată ca zona de energie pe unitate sau ca forță care acționează pe unitatea de lungime, atunci toate componentele de mai sus ale energiei de suprafață poate fi exprimată prin vectorii de forță.
Pe unitatea de lungime a perimetrului sunt trei forțe:
1. Energia de suprafață a corpului solid, care caută să se diminueze, se întinde meniurile de pe suprafață. Această energie este egală cu tensiunea superficială a corpului solid la interfața cu aer # 963; TG.
2. Energia superficială a solidului și lichidul # 963; TJ are tendința de a comprima picătură, adică energia de suprafață este redusă prin reducerea suprafeței.
3. Energia la suprafață a lichidului scade cu aer # 963; xi este tangentă la suprafața sferică a picătură.
unghi # 952;. formate de tangentelor la interfaciale suprafețele de limitare a fluidului de umectare, și având un vârf pe linia de delimitare dintre cele trei faze se numește unghiul de contact sau unghiul de umectare.
proiecția # 963; xi pe axa orizontală - produsul # 963; xi · cos # 952; .
Condițiile de echilibru:
Raportul primit (9.9) se numește ecuația lui Young.
În funcție de valorile unghiului de contact de echilibru, există trei tipuri principale de umectare:
Ecuația Analiza lui Young
Exemplu: apa de pe suprafața metalică acoperită cu pelicula de oxid. Mai mic unghiul # 952; și mai mult cos # 952;. cu atât mai bine umezirea.
2. În cazul în care # 963; TG <σТЖ . то cos θ <0 и θ> (Un unghi de contact obtuz) 90 ° - nonwetting. Exemplu: apă pe parafină sau teflon.
3. În cazul în care # 963; TG = # 963; TJ. apoi cos # 952; = 0 și # 952; = 90 ° - limita dintre umectare și non-umezire.
4. În cazul în care. apoi cos # 952; = 1 și # 952; = 0 ° - umezirea completă (împrăștiere) - picăturii se raspandeste intr-un film subțire. Exemplu de mercur pe suprafața de plumb, jupuit de pe pelicula de oxid.
Finalizarea non-umezire, adică o situație în care # 952; = 180 °, nu se observă, deoarece contactul corpurilor condensate energiei de suprafață scade mereu.
Unele hidrofilie apă de solide caracterizate prin următoarele unghiuri de contact: cuart - 0 °, malachit - 17 °. Carbon - 55 °, parafină - 106 °. Mai rău teflon umezit cu apă, unghiul de contact - 120 °.
Various lichid neuniform umectat cu aceeași suprafață. Conform regulii aproximative - umezește mai bine suprafața pe care lichidul, care este mai aproape de polaritatea unui agent de umectare.
În funcție de tipul de umectare selectivă a tuturor solidelor sunt împărțite în trei grupe:
· Hidrofili Materiale (oleofobi) - mai bine udate cu apă decât prin hidrocarburi nepolare din cuarț, silicați, carbonați, oxizi și hidroxizi de metale, minerale (unghi de umectare mai mic de 90 ° pe partea de apă).
· Hidrofobă (oleofilică) -better umectat materiale lichide nepolare decât apa: grafit, carbon, sulf, parafină, teflon.
Exemplul 9.1. Se determină unghiul de contact format dintr-o picătură de apă pe corp solid, în cazul în care tensiunea superficială la pneumo, solid-apă și apă-aer solid, respectiv: 0057; 0.020; 0074 J / m 2. este apa uda aceasta suprafata?
cos # 952; <0 и θ> 90 ° - această suprafață nu este umectat cu apă.
Flotația este cele mai frecvente metode de prelucrare a mineralelor. Această metodă a fost îmbogățită de aproximativ 90% din metale neferoase, cărbune, sulf și alte materiale naturale.
Flotația (separare) bazate pe diferite higroscopicitatea minerale și ganga. În cazul flotație cu spumare prin suspensia apoasă a minereului măcinat (pulpă) este bule de aer, purjat care aderă la hidrofobe particulele minerale valoroase (metale pure sau sulfurile acestora), apoi pop suprafața apei, iar spuma formată îndepărtate mecanic pentru prelucrarea ulterioară. rocă sterilă (cuarț, silicat de aluminiu), sunt bine umezită cu apă și se stabilește în flotație.
Exemplul 9.2. silice și sulf pulbere turnat pe suprafața apei. Care fenomen poate fi de așteptat în cazul în care contactul unghi cuarț 0 °, 78 ° și sulf.
Deoarece cuarț # 952; = 0 ° - umezirea completă, silicea este complet umezit cu apă și se depun la baza recipientului. Unghiul de contact al sulfului este aproape de 90 °, prin urmare, sulful va forma o suspensie de pulbere pe suprafața apei.
Caracteristici interfaciale curbat
Luați în considerare un alt importante sisteme de calitate dispersează asociate cu fragmentarea - o creștere bruscă în curbura suprafeței particulei în raport cu un plan.
Pentru excesul de presiune intramoleculară apare curbura suprafeței fazei lichide dispersate (ris.9.6):
în care: - diferența de presiune pe suprafața curbată () și o presiune peste suprafața plană ().
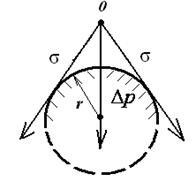
Rezultanta forțelor de tensiune de suprafață ca mărime vectorială compensată de putere. care este îndreptată spre centrul particulei și perpendicular pe suprafața sa. Lucrarea este realizată de curbura suprafeței. care reduce volumul corpului cu o sumă dV. . (9.11)
Ecuația privind suprafața de presiune intramoleculară excesul având o rază de curbură r:
· Pentru suprafața sferică:
· Pentru suprafața cilindrică:
· Pentru particule de formă arbitrară:
Ecuațiile (9.12-9.14) reprezintă legea presiunii capilare Laplace pentru suprafața sferică, cilindrică și o suprafață de formă arbitrară.
Curbura suprafeței poate fi pozitiv sau negativ. În cazul în care centrul cercului se află în interiorul corpului (ris.9.5), curbura este considerat pozitiv dacă> 0 - suprafața convexă, excesul de presiune suplimentară crește presiunea internă a fluidului (comprimă). Semnul „+“ în ecuația Laplace pentru o suprafață convexă: