Prima / teorie să se pregătească pentru examen / 3.1. Teoria structurii compuși organici, omologi și izomeri (structurale și spațiale). Influența reciprocă a atomilor în molecule.
Chimie organică - secțiunea chimică în care studiul compușilor de carbon, structura lor, proprietățile și interconversie.
Însăși denumirea disciplinei - „Organic Chemistry“ - a existat destul de mult timp. Motivul pentru aceasta constă în faptul că majoritatea compușilor de carbon, cercetătorii au întâlnit în faza inițială a științei chimice au avut de origine vegetală sau animală. Cu toate acestea, ca o excepție, compușii de carbon individuali se referă la anorganică. Astfel, de exemplu, substanțe anorganice considerate ca oxizi de carbon, acid carbonic, carbonați, bicarbonați, acid cianhidric, și altele.
În prezent, știm un pic mai puțin de 30 de milioane de diferite substanțe organice, iar această listă este actualizată în mod constant. Un astfel de număr mare de compuși organici se datorează în principal următoarele proprietăți specifice ale carbonului:
1) atomi de carbon pot fi unite într-un lanț de lungime arbitrară;
2) este posibilă nu numai secvențial (liniar) un compus de atomi de carbon, unul cu celălalt, dar, de asemenea, ramificată și ciclică chiar;
3) posibile tipuri diferite de legături între atomii de carbon, și anume, single, duble și triple. Astfel de valență carbon în compuși organici este întotdeauna patru.
În plus, o largă varietate de compuși organici și, de asemenea, contribuie la faptul că atomii de carbon capabile să formeze legături cu atomii și multe alte elemente chimice, cum ar fi hidrogen, oxigen, azot, fosfor, sulf, halogeni. În acest caz, hidrogen, oxigen și azot sunt cele mai frecvente.
Trebuie remarcat faptul că, pentru o lungă perioadă de timp a reprezentat chimia organică pentru oamenii de știință „pădure întunecată“. Pentru un timp, chiar și în vitalismul știința era teorie populară, potrivit căreia substanțele organice nu pot fi obținute mod „artificial“, adică este materie vie. Cu toate acestea, teoria vitalism nu a durat foarte mult timp, datorită faptului că una câte una detectată substanță, a cărei sinteză este posibilă în afara organismelor vii.
Cercetatorii perplexând fapt că mulți compuși organici au aceeași compoziție calitativă și cantitativă, cu toate acestea, de multe ori au proprietăți fizice și chimice destul de diferite. Astfel, de exemplu, dimetil eter și etanol sunt exact aceeași compoziție elementară dar dimetileter în condiții normale este un gaz și alcool etilic - lichid. În plus, dimetil eter cu sodiu nu reacționează, iar alcoolul etilic este reacționat cu ea, eliberând hidrogen gazos.
Cercetatorii din secolul al XIX-lea a fost făcut o mulțime de ipoteze cu privire la modul în care toate aceleași substanțe organice aranjate. Ipotezele esențiale au fost invocate de F.A.Kekule om de știință german care a sugerat mai întâi ideea că atomii diferitelor elemente chimice au valori specifice valențele și atomi de carbon în tetravalent organic și capabil să se alăture unul cu celălalt pentru a forma un lanț. Ulterior, pornind de la ipotezele Kekulé, om de știință român Alexei Mihailovici Butlerov a dezvoltat o teorie a structurii de compuși organici, care nu și-a pierdut relevanța astăzi. Luați în considerare ipotezele de bază ale acestei teorii:
1) toți atomii din moleculele substantelor organice conectate unele cu altele, în ordine în funcție de valența lor. atomi de carbon au o valență constantă egală cu patru și pot forma împreună un lanț de structură diferită;
2) proprietățile fizice și chimice ale oricărui material organic nu depinde numai de structura sa moleculară, ci și la ordinul lanurilor atomice în moleculă, împreună;
3) atomi individuali și grupurile de atomi într-o moleculă influențează reciproc. O astfel de interferență se reflectă în proprietățile fizice și chimice ale compușilor;
4) examinarea proprietăților fizice și chimice ale compusului organic poate stabili structura sa. Converse este de asemenea adevărat - cunoașterea structurii moleculare a unei substanțe, proprietățile sale poate fi prezis.
În același mod ca legea periodic D.I.Mendeleva a devenit fundamentul științific al chimiei anorganice, teoria structurii substanțelor organice AM Butlerova de fapt, a devenit punctul de plecare în dezvoltarea chimiei organice ca știință. Trebuie remarcat faptul că, după stabilirea teoriei structurii Butlerova chimiei organice a început dezvoltarea într-un ritm foarte rapid.
Izomerie și omologie
Conform celei de a doua teorie poziția Butlerova, proprietățile materialelor organice depind nu numai de compoziția calitativă și cantitativă a moleculelor, dar, de asemenea, pe ordinea lanurilor atomice in aceste molecule cu altele.
În acest sens, fenomenul de izomerie pe scară largă în rândul substanțelor organice.
Izomerie - un fenomen atunci când diferite substanțe au exact aceeași compoziție de molecule, de exemplu, aceeași formulă moleculară.
Foarte des izomerii diferă în proprietățile fizice și chimice. De exemplu:
tipuri de izomerie
izomer structural
a) un schelet izomerie carbon
c) izomerul Interclass:
izomerie Interclass are loc atunci când compușii sunt izomeri aparțin diferitelor clase de compuși organici.
regioizomeri
Regioizomeri - un fenomen atunci când diferite substanțe cu aceeași ordine de atașare a atomilor una față de alta diferă una de cealaltă poziție fixă și diferiți atomi sau grupuri de atomi în spațiu.
Există două tipuri de izomerie spațială - geometrice și optice. Obiective pe izomerul optic nu este găsit pe examen, astfel încât să ia în considerare doar geometrică.
Dacă o moleculă dintr-un compus are o dublă C = legătură C sau un ciclu, uneori, în astfel de cazuri, este posibil fenomenul de izomer geometric sau cis-trans.
De exemplu, acest tip de izomerie este posibila butenă 2. Sensul său este faptul că legătura dublă între atomii de carbon, de fapt, are o structură plană și substituenții de pe acești atomi de carbon pot fi localizate în mod fix, fie deasupra, fie dedesubtul acestui plan:
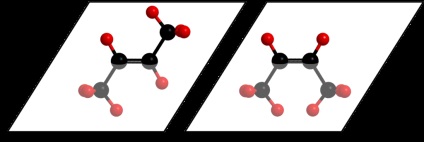
Când aceiași substituenți sunt pe aceeași parte a planului spun că este izomerul cis, și atunci când diferiți - izomerul trans.
În formulele structurale sub formă de izomeri cis și trans (de exemplu, 2-butenă), este descrisă după cum urmează:
Rețineți că izomeria geometrică nu este posibilă în cazul în care cel puțin un atom de carbon din dubla legătură va avea doi substituenți identici. De exemplu, cis-trans izomeri nu este posibilă Ocolire:
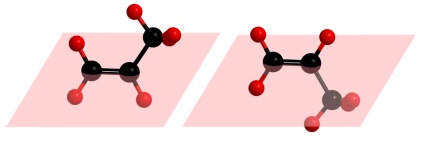
După cum se poate observa din ilustrația de mai sus, în cazul în care radicalul metil swap și un atom de hidrogen situat la al doilea atom de carbon pe fiecare parte a planului, vom obține aceeași moleculă, care tocmai se uita pe cealaltă parte.
Efectul atomilor și grupe de atomi în fiecare alte molecule organice
Conceptul de structură chimică ca o secvență asociată cu fiecare alți atomi a fost îmbunătățită în mod semnificativ odată cu apariția teoriei electronice. Din punctul de vedere al acestei teorii poate explica atomi și grupuri de atomi cum într-o moleculă de influență reciproc.
Există două moduri posibile de a influența o moleculă la alte domenii:
1) Efectul inductiv
2) Efectul mezomeric
efect inductiv
Pentru a demonstra acest fenomen ia, de exemplu, molecula este 1-cloropropan (CH3 CH2 CH2 Cl). Legătură între atomii de carbon și clorul polar, ca clorul are o electronegativitate mult mai mare comparativ cu carbon. Ca urmare a deplasării densității de electroni pe atomul de carbon un atom de clor la un atom de carbon care formează o încărcare parțială pozitivă (δ +), un atom de clor - o parțial negativă (δ-):
Deplasarea densității de electroni de la un atom la altul este adesea notată cu săgeata îndreptată spre atomul mai electronegativ:
Cu toate acestea, interesant punct este de așa natură încât, în afară de deplasarea densității de electroni de la primul atom de carbon la un atom de clor, de asemenea, are o deplasare, dar într-o măsură mai mică la al doilea la primul atom de carbon, precum și de la al treilea la al doilea:
O astfel de schimbare a densității de electroni în lanțul de sigma obligațiuni numit efect inductiv (I). Acest efect atenueaza ca distanța față de grupurile care afectează și deja, practic, nu are loc după trei sigma-obligațiuni.
În cazul în care atomul sau gruparea de atomi au o mai mare electronegativitate comparativ cu atomii de carbon pentru a spune că acești substituenți prezintă efect inductiv negativ (-I). Astfel, în exemplul de mai sus are un inductiv atom efect de clor negativ. De asemenea, clorul efect inductiv negativ au următorii substituenți:
Dacă electronegativitatea unui atom sau grup de atomi electronegativitate puțini atomi de carbon, de fapt, există un transfer al densității de electroni astfel de substituenți la atomii de carbon. În acest caz, se spune că substituentul are un efect pozitiv inductiv (+ I) (un electron).
Astfel, substituenții cu + I -effect sunt limitative radicali de hidrocarburi. expresie + I-efectul crește cu radical hidrocarbonat elongație:
Trebuie remarcat faptul că atomii de carbon din diferite state de valență, și au, de asemenea, diferite electronegativitate. Atomii de carbon în stare sp hibridizare au o mai mare electronegativitate comparativ cu atomii de carbon din sp2 stare de hibridizare, care la rândul său este mai electronegativ decât atomii de carbon în stare sp3 hibridizare.
efect mezomeric (M). sau un efect de cuplare - efectul deputatului, transmis prin sistemul de conjugate tt-obligațiuni.
Semnul efectului mezomeric este determinată de același principiu ca semn al unui efect inductiv. Când substituentul crește densitatea de electroni în sistemul conjugat, are un efect pozitiv mezomeric (+ M) și este un electron. efect mezomeric pozitiv au un dublu legături carbon-carbon, substituenții având o pereche de electroni unshared: -NH2. CHOH, halogeni.
efect mezomeric negativ (-M) posedă substituenți trage densitate de electroni din sistemul conjugat, în care densitatea de electroni a sistemului scade.
efect negativ mezomeric au grupuri:
Datorită redistribuirea densității de electroni datorită efectelor mezomerice și inductive în moleculă, în unele atomi apar sarcină pozitivă sau negativă parțială, care se reflectă în proprietățile chimice ale substanței.
efect mezomeric arată grafic săgeata curbată care pornește de la centrul densității de electroni și se termină acolo unde este deplasată densitatea de electroni. De exemplu, în molecula de clorură de vinil efect mezomeric are loc atunci când interfațare pereche de electroni unshared unui atom de clor, o legătură π electroni între atomi de carbon. Astfel, atomul de clor rezultat apare sarcină pozitivă parțială, și având mobilitate norului π-electron sub influența unei deplasări pereche de electroni față de atomii de carbon extreme, care are loc din cauza acestei sarcini negative parțiale:
Dacă molecula are alternativ legături simple și duble, atunci spunem că molecula conține un sistem π-electron conjugat. O caracteristică interesantă a acestui sistem este că efectul mezomeric nu se descompună.