Chimie și Inginerie Chimică
câmp de forță constantă în timp numit conservator dacă dă o funcție scalară evaluată F = F x, y, z) - potențial, al cărui gradient negativ este de a forța [c.123]
O situație similară se observă și în cazul cadmiu, pe baza faptului că acesta este acoperit cu o peliculă de CC1 (0H) 2 (PR = 2-10). Potențialul calculat este -0.54 V și este relativ pozitiv la potențialul de fier, în timp ce potențialul real mai negativ decât pentru fier (vezi. Tabelul 3.3.). Efectele observate potențial cadmiu mai negativ, probabil datorită cunoscut CC1 predilecția + ioni pentru a forma complecși. Sd care reduce activitatea ion la o valoare mai mică. decât soluția saturată corespunzătoare C (1 0H). - Notă. AUT [c.226]
Influența cantității de ioni monovalenți -potential membrane colodiu încărcate negativ poate fi ilustrată prin datele 3. P. Kozmina obținute pentru 0,001 n. soluții de cloruri ale metalelor alcaline (Fig. 96). Pentru ionii bivalenți datele relevante sunt prezentate în Fig. 94. [c.157]
Cantitatea q curent numit de schimb (mai precis densitatea de curent de schimb). În cazul în care potențialul este mai negativ decât echilibrul, apoi [c.217]
E ° 2 -... Potențialul electrodului Cantitatea mai puțin algebric (în calcularea electromotoare celulei electrochimice luată valoare potențială mai puțin algebric potrivit-XIV 2 tabele, se scade din potențialul unei valori algebric mai mare, cu alte cuvinte, de potențialul polul pozitiv al electrochimica elementul potențial scade polul negativ). [C.325]
Pentru depunere de metal. argint având un potențial mai negativ (plumb, cadmiu, zinc) trebuie aplicate sau mercur amalgamate electrod de platină. In cazul electrodului de platină simultan cu depunerea de metal este eliberat hidrogen. [C.64]
Dacă potențialul este mai negativă decât echilibrul, apoi 1k> 1 pe sistem și prin fluxurile de curent catodic. Dacă f> fr, atunci n> (pe sistem și curentul anod curge. Folosind ecuația Arrhenius. Expresiile pentru k și poate fi scris ca (neglija adsorbția g () 1-potențială) [C.10]
Prin puterea de oxidare a oxigenului dizolvat în apă sunt mult mai activi ioni de hidrogen și, prin urmare, apa care conține oxigen este mai periculos în otnoscheniya coroziune. Coroziunea amplificat n prin creșterea concentrației de ioni de hidrogen în soluție. Suprafață metale și aliaje reale sunt, de obicei eterogene, unele dintre porțiunile sale diferă potențial de electrod. Ca urmare, apare coroziunea pe acele părți ale metalului, unde potențialul este negativ. [C.148]
Coroziunea cu caracteristică depolarizarea hidrogenului metalelor. având un potențial de electrod mai negativ decât hidrogen, și începe de obicei în medii acide. Cu toate acestea, un număr de metale activ. de exemplu, magneziu și aliajele sale coroda, în același mod în mediu neutru și alcalin datorită recuperării hidrogenului din moleculele de apă prin reacția [C.35]
În timpul funcționării, sarcina celulei electrochimice, adică. E. În condițiile în care electrozii pozitivi și negativi sunt conectate la un circuit extern. prin care un curent (ohmi, Fig. 1), potențialele de electrod sunt deplasate din valoarea de echilibru. Electronii trec printr-un circuit extern de la un rezultat negativ la un electrod pozitiv în timp ce potențialul de electrod negativ devine mai pozitivă (sau mai puțin negativă). potențialul de electrod pozitiv devine mai negativ (sau mai puțin pozitiv). Pentru unii electrozi schimbare potențial de valoarea de echilibru este o mică valoare. De exemplu, electrodul de zinc pentru o astfel de schimbare este în mod normal, 0,05-0,2 B, [C.20]
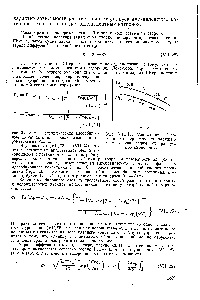
Fig. VII particule, 12. Dependența -potential încărcate negativ din argilă, raza contra l
În cazul depolarizer organice. Nu am o taxa, principalul factor. care afectează ușurința de recuperare a acestora, este schimbarea în g) -potential. Aceasta se manifestă într-o formă suficient de pură. în cazul electrolitului de suport este format din ioni individual încărcat (în absența adsorbției specifice și influența acestora asupra procesului de reducere a pH-ului). Prin urmare, atunci când. creșterea concentrației de electrolit valoarea absolută de susținere a z) electrod negativ -potential se reduce în consecință, moleculele organice crește rata de recuperare a neîncărcate, adică. e. 1/2 deplasate spre valori mai negative potențiale. [C.14]
Ceea ce se numește ioteitspalom electrocinetică Ce factori g.lpyagat privind potențialul de a schimba potențialul negativ În ceea ce privește [) I / chastnts ksiiyh când este introdus în azotatul de sol de potasiu. ba [) și lantan Ia [c.103]
Din toate cele de mai sus, devine clar de ce capacitatea de a comprima un strat dublu electric și pentru a reduce creșterea g poten-Tial în număr de cationi la Li + s +, iar anionii din seria p la 1. In Fig. VII, 12, prezentat și Jenny a găsit dependență Reytemeye-set -potential încărcate negativ particule de suspensie apoasă de argilă saturată cu diferite contraioni mono- și bivalenți, pe dimensiunea ionilor. După cum puteți vedea, [c.186]
Lantanide - reducerea puternic electrod lor negativ potențial și variază -2.4--2.1 în. Ele se descompun apa (de preferință, prin încălzirea) și ușor reacționează cu acizi pentru a forma săruri ale elementelor trivalente. Activitatea Restorative cade de la ceriu la lutețiu. Ele sunt ușor de oxidat de oxigen, primele trei elemente la temperatura obișnuită. iar celălalt prin încălzire. La această TION EeJ-to-se extinde de la eliberarea unei cantități mari de căldură, în mod tipic oxizi sunt formate și D. compoziția Me ceriu, praseodim și terbiu sunt oxidați la SeOa, RgvO și T40. Oxizii de lantanide sunt oxizi de bază. Ei combină energic cu apă pentru a forma hidroxizi, caracterizate prin solubilitate scăzută în apă. Ele pot fi preparate prin reacții de schimb de săruri de lantanide cu alcalii tari. Personajul principal cade din hidroxizii Ce (OH) a unui Lu (OH) z, în legătură cu reducerea razei ion feric (compresie lantanide). Hidroxizii de ultimele două elemente caracter slab are capacitati amfoter. [C.334]
Electromotoare SIPA circuitul (e. Q. S.) electrochimică determinată de cea mai mare diferență între potențialul electrozi pozitivi și negativi. Reacția electrochimică are loc până atunci. în timp ce există această diferență. În timpul reacției, electrodul negativ potențialele schimburi la partea pozitivă, și un rezultat pozitiv - în negativ. Când potențialul electrozilor sunt aliniate, e. d. a. dispare, sistemul vine n echilibra reacția se oprește. Ar trebui, cu toate acestea, amintiți-vă că există o diferență de potențial în circuit chiar înainte de zamosaniya în modul de e zampsaniya scurt. d. a. Circuit electrochimică este zero, deoarece potențialul electrozilor din cauza polarizării sunt substanțial identice. În acest mod, reacțiile electrochimice trece mai rapid și sistemul dă curentul maxim. [C.17]
Cursul de Chimie Fizică Edition 3 (1975) - [c.573]