Celulele electrochimice sunt sursa de tensiune de CC și sunt numite elemente primare. Energia electrică obținută în acest caz, se formează ca rezultat al reacțiilor chimice care au loc în interiorul celulei. Luați în considerare principiul unei celule simplu.
(. Figura 48) Elementul constă dintr-un vas cu o soluție de acid sulfuric (SO4 H2), în care două plăci diferite transportate: zinc și cupru. Experiența a arătat că, în acest caz de zinc încărcat
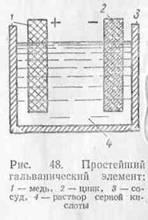
negativ, și cupru - este pozitiv. Elementul are două O - pol: pozitiv (anod) și negativ (catod).
placă de zinc, coborât în soluție de acid sulfuric pentru a fi dizolvat în acesta. Capacitatea de a da cu ușurință electronii săi de zinc duce la faptul că atomul de zinc. lăsând electroni lui două plăci. Se merge în soluție ca un ion pozitiv. Între placă și soluția de zinc există o diferență de potențial, care suspendă dizolvarea ulterioară a plăcilor de zinc.
Omit soluția placa de cupru. Cu dizolvare capacitate mai mică de cupru în raport cu soluția va avea o diferență de potențial diferit de zinc. Astfel, între plăcile de cupru si zinc format diferență de potențial.
Diferența de potențial (e. Q. S.) între plăcile (electrozii) elementul de cupru-zinc este egal cu 1,1.
Când elementul de închidere electroni pol zinc metalic placa conductor se va muta la placa de cupru. Datorită pierderilor potențiale de electroni între placă și soluția de zinc este redusă și o nouă porțiune de ioni de zinc trece în soluția din placă, placa în sine este îmbogățită din nou de electroni. ioni de zinc pozitivi, o dată în soluție, sunt conectate la negativ SO4 rest de acid ioni - și forma zinc molecula de sulfat
Pozitiv hidrogen ion H2 ++. merge la placa de cupru,
este nevoie de electroni liberi și se neutralizează, este eliberat sub formă de bule care acoperă placa de cupru. Ca rezultat al acestui proces foaia de zinc, fiind dizolvat în acid, replenishes electroni și o placă de cupru, dand electroni mentine sarcina pozitiva si este acoperita de bule de hidrogen. mișcarea de electroni are loc în circuitul exterior de la placa de zinc la cupru, electrolitul din interiorul ionilor negativi se deplasează de cupru la zinc, iar ionii pozitivi - din zinc la cupru. Ampermetru în elementul de cupru-zinc de operare a circuitului descrește rapid. Acest lucru se datorează faptului că placa de cupru, împreună cu hidrogen, care acoperă această placă formează un fel de cuplu galvanic, un fel de element singular, e. d. a. care este îndreptată împotriva
e. d. a. elementul în sine. Acest fenomen se numește polarizare. Din cauza puternic polarizare a elementului de cupru-zinc nu a fost găsit o aplicație practică.
Printre elementele non-polarizabil includ celule de zinc-carbon. Electrozii îi servesc plăci de cărbune și zinc, electrolit - soluție de clorură de amoniu (NH + C1). Tija de carbon este coborât în mangan peroxid sac (MnO2), care elimină polarizarea și numit depolarizer. E. g. Cu. 1,45 per articol. În timpul funcționării unui hidrogen cu celule de zinc-carbon eliberat din soluție reacționează cu mangan peroxid:
rezultând în apă, iar elementul de polarizare are loc.
Majoritatea elementelor zinc-carbon sunt realizate sub forma așa-numitei celule uscate.
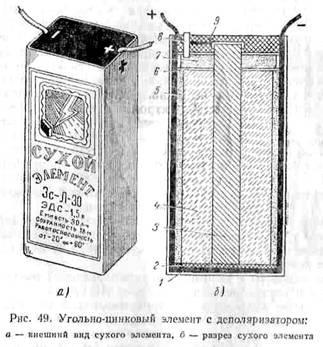
Fig. 49 ilustrează o depolarizare mangan celule uscate. Element de zinc este plasat într-o cutie 2, care este de asemenea polul negativ al elementului. top box lipite peste carton. In mijlocul cutiei este tija de carbon 3, care este polul pozitiv al elementului. în jurul
carbon tijă 4 depolarizer este compus din granule sfărâmate de peroxid de mangan, grafit și negru de fum, înmuiate în soluție de amoniac. Depolarizer plasate într-un sac din muselină. Pentru izolarea depolarizer zinc din zinc la cutia de carton fund șervețel 1 este pus.
Afară sac depolarizer 5 este înconjurată de o pastă compusă din făinuri ieftine impregnate cu o soluție de clorură de amoniu. Pentru a preveni uscarea pastei de la dezintegrarea și formularea acestuia este clorura de zinc. Top husă depolarizer garnitură de carton 6, este turnat peste care un strat de rumeguș 7, de asemenea, acoperite cu o căptușeală de carton.
De cutii de zinc și tija de carbon făcut două off. Pentru îndepărtarea gazelor produse în timpul funcționării celulei, deasupra ei un tub de sticlă 8. Porțiunea superioară elementului 9 este umplut cu rășină.
Elemente uscate sunt mangan depolarizare e. d. a. 1,4-1,6 în rezistență internă 0,1-0,5 ohmi.
Cea mai mare cantitate de energie electrică în amperi-ora, ceea ce poate face ca elementul în proces, numit un element de capacitate.
Celulele sunt Electrochimice folosite pentru a alimenta radiourile bateriei, unele din aparatele fizice și electrice, de iluminat portabile, semnalizare.
Celulele galvanice și alte surse de energie chimică notat în mod convențional în diagramele, așa cum se arată în Fig. 50.