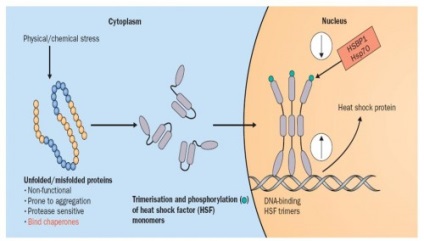
Răspunsul la șoc termic. proteine de stres
proteine de șoc termic ca chaperone moleculare
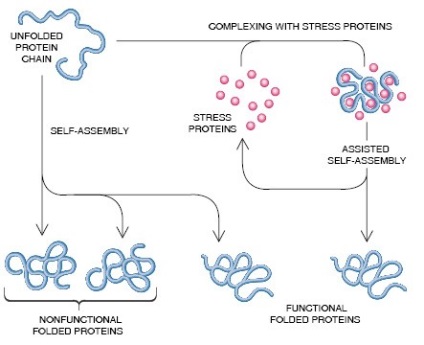
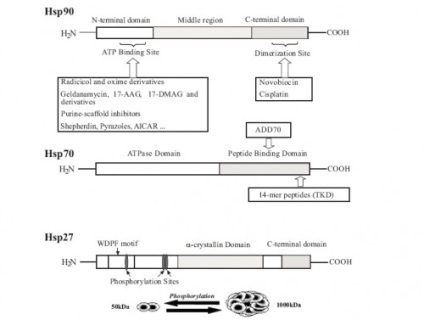
Studiu in continuare a clasei HSP au aratat ca aceste proteine nu sunt induse numai de stres, dar multe dintre ele functioneaza chaperone kakmolekulyarnye constitutiv, participarea la stabilizarea și se deplasează peptide imature cu creșterea normală. De exemplu, proteinele Hsp70, Hsp90 sunt prezenți în concentrații mari în celule non-stresante care constituie 1-1,5% din proteina celulară totală, ceea ce indică o nevoie continuă în menținerea homeostaziei celulare conformationala proteinele sale. Aceste proteine sunt localizate în citosol, mitocondriile, reticulul endoplasmic și nucleu. greutăți moleculare HSP sunt în intervalul 15-110 kDa. Cele mai studiate sunt de mamifere HSP 60 proteine, 70, 90 și 110 kDa, care joacă un rol important în procesele fundamentale intracelulare - asupra acțiunii antiapoptotice plierii și intracelulară traficul de proteine.
Funcția HSPs ca chaperone pot fi rezumate după cum urmează:
1. Coagulare lanțuri polipeptidice imature;
2. Facilitarea circulației proteinelor în diferite compartimente celulare;
3. Modularea activității proteinei prin stabilizarea și / sau maturarea conformatiei competente funcțional;
4. Suport formarea / clivaj multiproteic complecși;
5. Proteinele de corecție misfolded;
6. Protejarea proteinelor din agregarea;
7. Direction deteriorat complet proteine la clivaj;
8. Proteina din agregate distruse;
9. solubilizarea proteinelor agregatelor pentru degradarea ulterioară.
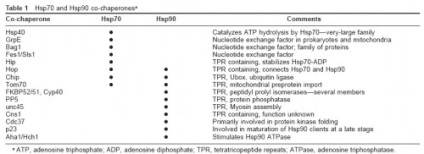
Funcțiile unor co-chaperone
proteine HSP70 cu co-shareponami efectuate în cel puțin două activități formă alternativă. preveni agregarea proteinelor non-native când se leagă regiunile hidrofobe ale moleculelor substrat, prin protejarea acestora de interacțiuni intermoleculare ( „securitate“, „deținător“ activitate) și promovează, de asemenea intermediari de coagulare non-native la starea nativă ( „dosarul“ Activitate „coagulare“ ).
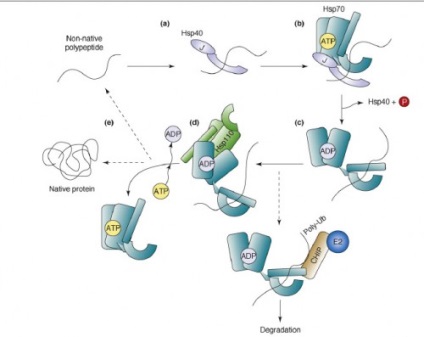
HSP și ATP-loop azny
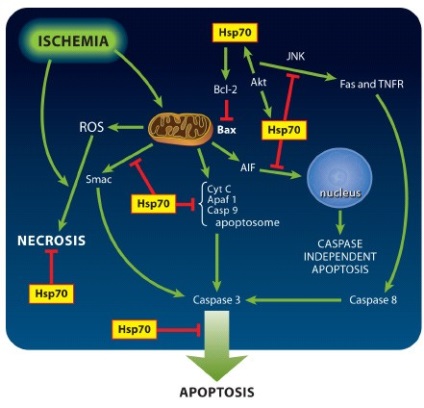
proteine de șoc termic în timpul ischemiei
Efectul anti-inflamator de proteine de șoc termic

acțiunea extracelulară a proteinelor de șoc termic
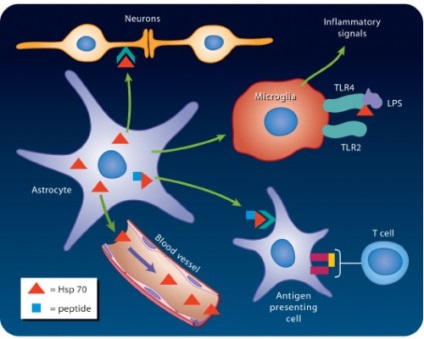
Rolul proteinelor de șoc termic în reacțiile imune
Terapia HSP si anti-cancer
Proteinele de soc termic sunt foarte exprimate in multe tipuri de cancer la om și sunt implicate în proliferarea celulară, diferențierea, metastază și recunoașterea celulelor tumorale de către sistemul imunitar. Ei sunt biomarkeri utili ai carcinogenezei în unele țesuturi și semnalează gradul de diferențiere și agresivitatea anumitor tipuri de cancer. De asemenea, nivelurile de HSP și anticorpi anti-HSP circulant poate fi util pentru diagnosticarea cancerului. Expresia crescută a HSP poate prezice, uneori, răspunsul la tratament anti-cancer. De exemplu, HSP27 și HSP 70 sunt implicate in rezistenta la chimioterapie in cancerul de san, nivelurile crescute de HSP27 prezice un raspuns slab la chimioterapie in leucemie. În același timp, expresia HSP70 sugerează efecte bune ale chimioterapiei în osteosarcom (a se vedea. Review).
In dezvoltarea terapiei anti-cancer cu HSP a jucat rolul de funcția lor dublă în organism. pe de o parte - vnutrikletochnayatsitozaschitnaya / anti-apoptotice. iar pe de altă parte - extracelular / imunogen.
Acest lucru a permis dezvoltarea a două strategii principale în terapia cancerului.
1) Expresia modificarea farmacologica HSP și activitatea ca chaperones moleculare;
2) Aplicarea HSP in vaccinuri anticanceroase pe baza capacității lor de a acționa ca un adjuvant imunologic.
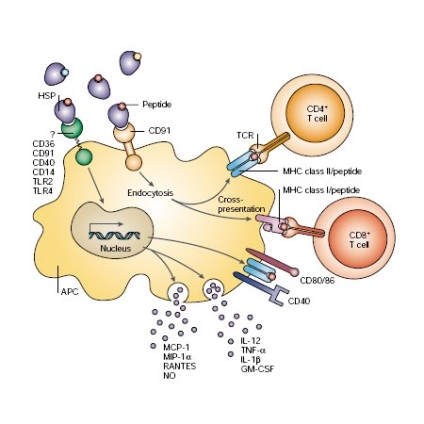
Capacitatea proteinelor de șoc termic leagă antigeni peptidici au format baza unei abordări immunotherapeutic pentru tratamentul cancerului. Izolate de la pacienți cu cancer cu complexele de peptide tumorale si Grp96 Hsp70 sunt folosite ca vaccin anti-cancer pentru tratamentul si prevenirea cancerului. Proteinele de șoc termic, cu excepția activității manifestări shaperonovoy la antigene tumorale peptidice facilitează intrarea în celule complexe HSP-peptide datorate endocitoză receptor. Acest lucru a permis suficient de rapid pentru a muta pe baza studiului de vaccin HSP in modele animale pentru tratamentul cancerului in clinica. Formele HSP-îmbunătățite sunt obținute prin separarea vaccinuri complexele HSP70 peptide din celulele dendritice fuzionate cu tumora.


Aceste medicamente sunt bazate pe diferite proteine de șoc termic, sunt in prezent in curs de studii clinice.
proteine de șoc termic în timpul îmbătrânirii
Pe masura ce imbatranim, organismul pierde capacitatea de a răspunde în mod adecvat la stres externe și să mențină homeostazia. Celulele mai vechi sunt mai predispuse la tulburări și boli, deci cu înaintarea în vârstă crește susceptibilitatea la acești factori.
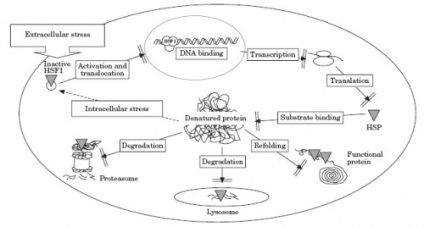
În timpul proteină de viață stabilă în aceasta experiență diverse modificări post-translaționale. Stabilitatea proteinelor este perturbat din cauza multor influențe nocive - oxidare laterală a lanțului, glicare, asparaginil dezaminare și reziduurile glutaminil, ceea ce duce la formarea de legături isopeptide. Sensibilitatea Proteotoksichnym la creșterea daune datorate erorilor în transcriere și translație, și defectele manifestate de coagulare proteinelor. Pentru îmbătrânire modificarea caracteristică creșterea proteine asociate cu coagulare homeostaziei (cm.). Funcția chaperone este afectată, nevoia crescută de degradare a proteinelor, dar activitatea principala proteolitică a unității, proteazomul, de asemenea, scade cu vârsta. rezultând riscul de glicare. Agregarea, de asemenea, însoțită de inhibarea proteazomului și oprirea ciclului celular. Este deranjat cu vârsta și degradarea lizozomală a proteinelor (probabil datorită supresiei lipofuscina). Acumularea de proteine misfolded și slăbirea apărării mecanismelor de rezultate în formarea agregatelor proteice de rupere functiile celulare si sunt cauza bolilor legate de varsta.
Pentru toate speciile studiate de organisme caracterizate prin prezența proteinelor denaturate și agregate în celulele senescente. La om, multe dintre bolile dependente de vârstă (Alzheimer, Parkinson, boli prionice etc.) sunt însoțite de acumularea de proteine clivate și / sau pliate corect, care au legătură cu perturbarea funcțiilor HSP.