Chimie și Inginerie Chimică
Deoarece protonul - singurul pozitiv încărcat particulele găsite în nucleu, numărul ordinal al unui element este numărul de protoni din nucleu. Miezul de aluminiu, un număr de serie 13, care trebuie să conțină 13 protoni, dar ca masa atomica este de 27, apoi în nucleul său, a fost găsit mai târziu, trebuie să conțină încă 14 neutroni. Neutronii schimba greutatea nucleului. dar nu afectează taxa. Nucleul atomului de sodiu al cărui număr de 11 de secvență, greutate atomică 23 trebuie sod chirci 11 protoni si 12 neutroni. (Și protoni și neutroni din nucleu se gasesc, de ce ele sunt numite nucleoni.) [C.157]
Defectul de masă caracterizează stabilitatea nucleelor atomice și nucleonilor energia de legare în nucleu. Defectul de masă corespunde energiei care este eliberată în timpul formării de nuclee de protoni liberi și neutroni și poate fi calculată din relația lui Einstein E - tf. unde E - energie m - masa, c - a vitezei luminii în vid (c = 3,10 m / s). [C.9]
După cum se vede din tabelul. 1, electronul de masă de aproape 1840 de ori mai mică decât masa unui proton și un neutron. Prin urmare, masa atom este practic egală cu masa nucleului - masa totală a nucleonilor - protoni și neutroni. [C.8]
Prima măsurare a mărimii nucleului atomic au fost realizate prin experimente de imprastiere Rutherford și particule. măsurători mai precise sunt realizate în experimente difuziei cu neutroni. deoarece neutronii nu sunt deviate de repulsie electrostatica a nucleelor. Numeroase experimente cu neutroni de imprastiere a arătat că raza de bază este proporțională cu rădăcina cub de numărul de nucleoni conținute în acesta, adică, că volumul nucleului este proporțională cu numărul de nucleoni sale. [C.407]
Conform teoriei proton-neutron de nuclee atomice, numărul de protoni din nucleu este egal cu sarcina nucleului 1 (când exprimarea ca de obicei, în ceea ce privește sarcina electronului), iar suma numărului de protoni și neutroni este numărul de masă A, m. Atom E. Greutate. exprimate în unități de greutăți atomice, rotunjită la unitatea cea mai apropiată. Astfel, numărul de neutroni este egal cu A-I. Acest lucru implică, în special, că diferiții izotopi ai elementului diferă unul de altul numai în numărul de neutroni din nucleu conținea același număr de protoni. Ambele tipuri de particule care constituie nucleul atomilor, - protonii și neutronii - notat cu termenul general - nucleoni. [C.51]
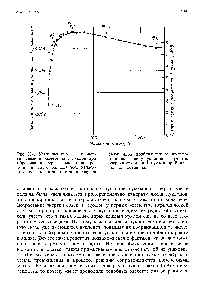
Fig. 23-1. Reducerea masei și energiei 1 pe nuclee nucleonice în formarea de electroni, protoni și neutroni. Pentru toate sfâräitul oxigen energia totală
În capitolul. 1, deja menționat, că nucleul este format din două tipuri principale de particule elementare. protoni și neutroni, care sunt numite colectiv nucleoni. Nucleul are o sarcină pozitivă. egal cu numărul de protoni conținute în acesta, și se numește un număr de serie 2 (atomic) numărul de nucleu. Într-un nucleu atom neutru înconjurat de electroni, al căror număr este egal cu numărul de protoni din nucleu. Deoarece proprietățile chimice sunt determinate de electronii atomici, atomi neutri, toate cu același număr de electroni (și protoni) sunt tratate ca un singur element atomi. Prin urmare, numărul de serie al unui atom indică faptul că acesta aparține unui anumit element. Numărul total de protoni și neutroni din nucleu sa numit număr A. masa [c.405]
În formarea așa ° atom Hg de electroni, protoni și neutroni în pierderea în greutate pe nucleon este [c.408]
Proprietățile nucleelor determinate de interacțiunea dintre nucleoni (protoni și neutroni) din nucleu. Fiecare nucleu se caracterizează printr-un anumit număr de nucleoni [c.42]
Este dovedit faptul că, în cazul reacției cauzate de energia de neutroni neutronului este cel mai (dacă nu toate) din această energie de excitare. Cu toate acestea, chiar și în cazul în care numerele de masă ușor de nuclee fisionabile diferă puțin, energia de legare poate fi variat cu aproape 50%, prin urmare, diferența în capacitatea de a partaja nuclee individuale. Aceasta este o schimbare relativ mare datorită influenței termenului chiar impar în formula pentru masa nucleului. Dacă M A, 2) - masa nucleului. care cuprinde un nucleoni, dintre care 2 - protoni, în unități atomice de masă [4] [C.11]
De asemenea, trebuie remarcat linie în zig-zag forma de izotopi stabili. iar izotopul prevalenței cu un număr par de protoni sau neutroni, sau chiar numărul total de neutroni și protoni. Acest lucru indică faptul că o anumită interacțiune între nucleonilor și existența structurii interne de bază. Prevalența marcantă a unui număr par de nucleoni fiecare tip este și mai evidentă atunci când se analizează tabelul. 23-2. [C.417]
Starea actuală a științei nucleului și structura acestuia este aproximativ aceeași poziție în care a existat teoria structurii atomice în 1925. Este posibil să se măsoare proprietățile nuclee, descrie și le clasifica, dar există încă o teorie generală. ne permite să explicăm aceste proprietăți. Nucleele sunt compuse din protoni și neutroni, sunt concentrate într-un volum mic și interacționează puternic numai cu vecinii săi imediați în nucleu. În unele privințe (acest lucru se aplică la energia de legare) acestea sunt picăturile ca comprimat de particule uniforme. dar în alte privințe (de preferință, un număr par de nucleoni și existența numerelor magice), care se comportă ca și în cazul în care învăluia formează structuri similare cu cojile de electroni. Diagrama de nivel energetic pentru nucleele pot fi construite pe baza spectrelor radiațiilor gamma transformărilor nucleare însoțitoare. Core. cum ar fi electronii dintr-un atom sunt, de asemenea, la sol și stări excitate. [C.435]
Se calculează energia de legare per nucleon ca urmare particule nucleare a) 1C (t = 12000 amu) b) MCT = 36.96590 amu) a) [c.438]
O parte a unui atom, care este în centru și încărcat pozitiv în miezul mai mare parte a atomului. Miezul este format din nucleoni (protoni și neutroni). Suma numărului de protoni și neutroni într-un atom se numește numărul de masă. [C.28]
Această energie specifică pe nucleon este de aproximativ 7-8 MeV. Kernel-ul, împreună cu protoni, neutroni și alte particule elementare. are un spin în plus, se caracterizează prin momentele magnetice și electrice. [C.43]
Modelele de mai sus, atât în compoziția cât și în ceea ce privește formarea energiei interacțiunii nuclee datorită particularităților nucleonilor din nucleu. În prezent, se presupune că, în forțele intranucleari este o interacțiune intensivă crucială între protoni și neutroni. Forțele în acest caz sunt prezentate la distanțe de 10 cm 2 și scad foarte rapid cu creșterea distanței (invers nu al doilea, și un grad semnificativ mai mare de ea). Alături de această interacțiune afectează repulsia reciprocă a protonilor din nucleu. Această repulsie este exprimată prin legea lui Coulomb, și scade odată cu creșterea distanței mult mai lent. Ca rezultat, la nuclee mai grele (din cauza lor mai mari), forțele de atracție ale particulelor. din care sunt realizate, sunt atenuate, iar repulsia reciproca a protonilor se manifestă energie relativ mai puternică a formării de nuclee de neutroni și protoni crește nu mai proporțională cu masa și într-o măsură mai mică, și, prin urmare, nuclee grele mai puțin stabile. În acest sens, pentru nuclee grele este important prezența neutronilor exces menționate mai sus, deoarece prin aceasta mărind distanța medie dintre protoni și slăbește repulsie reciprocă. [C.54]
Atracția reciprocă a nucleoni conduce la faptul că, în timp ce în stratul de suprafață al miezului. nucleoni ca moleculele de lichid de suprafață de acoperire în strat. sunt câteva circumstanțe speciale. adică existența un fel de tensiune superficială a miezului. În consecință, deformarea miezului. asociată cu creșterea costurilor de energie de suprafață necesită cea mai stabilă este o stare în care miezul are o suprafață mai mică. [C.54]
O anumită cantitate de orice substanță are o anumită rezervă de așa-numita energie internă. care constă din energia de mișcare (de translație, rotație, vibrație) a tuturor componentelor prezente de substanță sub formă de particule - .. moleculele, ioni, atomi, electroni, nuclee atomice, nucleoni, etc. într-o energie internă stoc nu intră energia de mișcare mecanică în datele întregului organism compus substanță și energie a poziției sale în câmpul gravitațional. Amploarea energiei interne a unui anumit masă a unei substanțe depinde de natura sa chimică. stare de agregare și de temperatură. [C.77]
Aceasta este energia medie pe nucleon necesară pentru separarea nucleului în părțile sale componente. Amploarea E și variază de la aproximativ 1 la 9 MeV în întreaga scara de masa. [C.8]
Pe energia de deformare este influențată de doi factori principali de tensiune de suprafață. datorită forțelor nucleare de interacțiune între componentele nucleonii nucleului, iar repulsia electrostatică de protoni. Atunci când oscilatie nucleu orice abatere de la forma inițială conduce la o creștere a potențialului energetic sa din cauza energiei tensiunii superficiale. Cu toate acestea, aceste deformații determina o redistribuire a protoni din nucleu și apariția centrelor de repulsie electrostatice. forțele de repulsie electrostatice reduce energia potențială a sistemului și de a contribui la creșterea în continuare a deformării. În cazul în care oscilațiile duce la halteră de bază în formă. forțele de repulsie electrostatice pot depăși forțele nucleare de atracție și de bază se dezintegrează în anumite circumstanțe. [C.10]
Atomii cu un număr diferit de protoni (2) și neutroni (K), dar cu același număr de nucleoni A) numit isobars ktotl cu același număr de protoni (2) numite izotopi și cu același număr de neutroni N) - izotonic. Exemple de nuclee - izotopi și isobars isotones - arătate mai jos [C.9]
Conform acestui raport cu reducerea greutății și 0.030376. e. m. cu nucleu de heliu obrazozanii doi protoni și doi neutroni corespunde cu eliberare cantități enorme de energie în cele 28, 2 MeV (1 MeV = 10 eV). Prin urmare, energia medie in nucleu pe nucleon este de aproximativ 7 MeV. Energia de legare a nucleonilor milioane de ori mai mare decât energia de legare a atomilor în moleculă (5 eV). Prin urmare, nu se schimba nucleele atomice din substanțe chimice reacții. [C.9]
În prezent, există aproximativ 300 de stabile și mai mult de 1.400 de nuclee radioactive. Este de notat faptul că nucleele cu numărul de protoni sau neutroni, la 2, 8, 14, 20, 28, 50. 82, iar numărul de neutroni 126, 152 sunt semnificativ diferite în proprietățile de celelalte. Se presupune că aceste numere magice de nucleoni corespund straturilor nucleare complete și substraturile. nuclee Magic poate fi numărul de protoni, numărul de neutroni și numărul de protoni și neutroni (de două ori magie). Prin nucleu dublu magice nu sunt (2p, 2n), (8p, 8n), n (14P, 14P), Ca (20p, 20p) și Pb (82R, 126p). La numarul protopit magic sunt 28Ni, 5 8n, VaR, și numărul de neutroni magice sunt de 5g (38P, 50P), 2r (40R, 50P), Ba (56R, 82p) 57 La (57r, 82p), ° Xie (58r, 82p) și altele. [C.9]
Izotopi. Teoria Proton-neutroni a făcut posibilă rezolvarea conflictului și un altul care a apărut în timpul formării teoriei structurii atomice. Dacă acceptăm că nucleul atomilor elementelor compuse dintr-un număr de nucleoni, greutățile atomice ale tuturor elementelor trebuie exprimate ca numere întregi. Pentru mulți membri acest lucru este adevărat, și minore (abateri de la numere întregi pot fi atribuite lipsei de precizie. Cu toate acestea, unele elemente ale maselor atomice, astfel se abate puternic de la numere întregi, acesta nu mai poate fi măsurarea nelochnostyu obyasnng și alte cauze accidentale. De exemplu, masa atomică 35,45 clor stabilește că aproximativ trei sferturi din atomi de clor natural au o masă de 35 și un sfert. - 37. Astfel, în mod natural elemente constau dintr-un amestec de atomi și eyuschih pa s și greutate, dar în mod evident aceleași proprietăți chimice. t. e., există soiuri de atomi de un element cu diferite mase integrale și, mai mult decât atât, F. Aston capabil să separe astfel de amestecuri în componente. izotopii care au fost numite din cuvintele grecești Izosov și topos. ceea ce înseamnă același loc și (avem în vedere faptul că diferite isogons singur element ocupă un loc în tabelul periodic), din punctul de vedere al teoriei izotopilor de protoni-neutronice sunt soiuri de articole. nucleu atom .ov -je care conțin un număr diferit de neutroni. dar același număr de protoni. Natura chimică a elementului, datorită numărului de protoni din nucleu, Ko [C.22]
Aceste relații definesc dependența greutatea nucleu. și, prin urmare, energia sa din cauza numărului și tipului conțin / kaschihsya în acesta nucleoni. Expresia exactă pentru energia de legare in nucleul compus neutronului cn obținut din ecuația [C.11]
Din (1.13) și (1.11) poate fi ușor de văzut că miezul compozit având un număr par de protoni și neutroni are o excitație de energie maximă. deoarece termenul b este negativ pentru aceste nuclee. Mai multe mari de energie mai mic de excitație obținută în nucleul compusului cu un număr impar de nucleoni și cel mai mic - în cazul nucleelor impar-impar. Prin urmare, izotopii nuclee și neutroni pot partaja orice energie, în timp și sunt împărțite numai cu neutroni rapizi. În cazul primei de captură a neutronilor trei nuclee duce la chiar-chiar structura compozită și energia de excitare. Numai datorită energiei de neutroni de legare (6,8 MeV), egal cu diviziunea de prag. Astfel, aceste miezuri pot partaja ambele neutroni (foarte lent) și rapid termice. Acesta proprietăți Egi permite nspolzovat astfel ca nuclee nuclee pogo combustibil. Mai jos se va arăta că aceste miezuri se încadrează atât de ușor în neutroni de energie termică, care neutroni pentru a încetini energiile tenlOBYh în mod corespunzător. întrebare Voob1tse de încetinirea neutronilor este una dintre teoria principale probleme de reactor. [C.11]
Chimia cursului Partea 1 (1972) - [C.37]
Chimie anorganică (1974) - [c.39]
Chimie anorganică Edition 2 (1976) - [c.40]
Chimie anorganică (1978) - [c.67]
Chimie generală Edition 18 (1976) - [c.104]
Chimie generală Edition 22 (1982) - [c.108]
Chimie anorganică (1969) - [C.35]