la lista de prelegeri
la lista de articole
producerea acidului azotic.
Acid azotic pur - lichid incolor, congelare la - 41 ° C, punct de fierbere la 86 ° C maxim Punctul de fierbere este de soluție 121,9 ° C, care conține 68,4% HNO3 și reprezentând un azeotrop. Acidul azotic - un oxidant foarte puternic. Multe substanțe organice sub acțiunea acidului azotic sunt degradate și unele sunt capabili să se aprindă. Mai ales puternic ca oxidant de acid azotic diluat. Acid azotic concentrat metale oferă protecție, cum ar fi fierul. Aceasta se bazează pe utilizarea oțelului ca material structural în producția de acid azotic.
bază fizico-chimică a procesului.
Producerea acidului azotic diluat din amoniac se compune din următoarele etape:
1. Oxidarea de contact a amoniacului la oxid de azot (II);
2. oxidarea oxidului de azot (II) la oxid nitric (IV);
3. Absorbția oxidului de azot (IV) cu apă pentru a forma acid azotic.
Reacția totală a formării de acid azotic este exprimată prin ecuația:
Contactați oxidarea amoniacului.
In oxidarea amoniacului în afară de reacția principală poate continua procesele secundare paralele.
și răspuns consistent
Justificarea rolului parametrilor și alegerea lor.
Temperatura are un efect redus asupra accelerării procesului, deoarece reacția este limitată prin difuzie externă. În același timp, NO ieșire variază cu temperatura în conformitate cu o lege de maximum extreme la 900-920 ° C datorită progresiei în regiunea de reacție (5), iar disocierea termică a amoniacului
și alte reacții adverse. De asemenea, odată cu creșterea temperaturii crește antrenării catalizator sub formă de oxid de PtO2 volatile. Pentru a capta plasa Pt este plasată sub un absorbant pe baza CaO, care preia mai mult de 50% din platină. Luarea în considerare a factorilor care conduc la opuse spus alegerea temperaturii optime 830-930 ° C (în funcție de combinația de alți parametri). Se va aprecia faptul că poziția temperatura optimă depinde de presiunea. Prin creșterea presiunii este deplasată la temperaturi mai ridicate, deși valoarea puterii maxime este redusă datorită creșterii proporției de reacție (6), cu o presiune tot mai mare.
Presiunea este un factor în accelerarea procesului, deoarece forța motrice a difuziei exterioare. Cu toate acestea, cu o presiune tot mai mare, o scădere a randamentului de oxid nitric (II). Prin urmare, presiunea este valoarea optimă, combinarea cerințelor reciproc opuse ale creșterii productivității și reducerea dimensiunii de instalare și îmbunătățirea randamentului NO. Trebuie de asemenea înțeles că atunci când antrenării presiune tot mai mare a celor mai mici particule de platină crește substanțial cu gazele, ceea ce mărește costul acidului materiilor prime, ca Platinum este costisitoare, iar procesul de captare a gazelor de azot, după aparatele de contact este foarte complicată și nu asigură caracterul complet al compensare a pierderilor. La instalațiile de mare putere moderne presiune optimă este de 0,4 - 0,7MPa.
Compoziția amestecului de gaz. La alegerea raportului de O2. NH 3 sunt ghidate de ieșire NO dependență de acest raport (Figura 1) asociat cu procesul de limitare difuzie a oxigenului la suprafața catalizatorului. Valorile optime ale O2. NH 3 Cantitatea este de 1,8 - 2,0, care corespunde conținutului de amoniac în amestec amoniac-aer este de 9,5 - 10,5 (V%.). De notat că, la temperatura normală, amestecul de amoniac și aer suflă în intervalul 16-27 (vol.%), În timp ce creșterea limitei de temperatură și presiune de explozie este extinsă.
timpul de contact. Catalizatorii de înaltă selectivitate permite condițiile optime de presiune, temperatură și raportul O2. NH 3 sunt de 97 - 98% NO ieșire atunci când conversia aproape completă a amoniacului. Deoarece NO cu creșterea timpului de contact se poate descompune în continuare la elementar N2 și O2. timpul de contact este ales pentru timpul minim la care se realizează practic conversie completă și care asigură un volum minim de reactor în condițiile de conversie completă a NH3. De data aceasta este egal cu (1 - 2) × 10 -1.
Oxidarea oxidului de azot (II) în dioxid.
Azotul gazos obținut prin oxidarea amoniacului conține oxizi de NO și alte azot, oxigen, azot și vapori de apă. Pentru oxid nitric acid azotic (II) este oxidat la silice.
Procesul de oxidare a NO cu oxigenul atmosferic este descris de ecuația
În conformitate cu principiul Le Chatelier acestei reacții de echilibru este deplasat spre dreapta, cu creșterea presiunii și scăderea temperaturii. Practic echilibrul de dioxid de azot la 100 ° C, este aproape complet deplasată spre dreapta. Viteza de proces constant, de asemenea, crește odată cu scăderea temperaturii. Acest comportament aberant al sistemului este legat de natura procesului de trimolecular (cm. „Chemical Kinetics“ curs „Chimie Fizica“ secțiune). Datorită cerințelor de schimbare a echilibrului și a accelera temperatura de proces ar trebui să fie redusă. Cu toate acestea, există o limită de temperatură mai scăzută, determinată de creșterea progresivă a costurilor de energie asociate cu utilizarea de agenți frigorifici. Cu toate acestea, scăderea temperaturii determină conversia parțială la dimer NO2
În practică, procesul se desfășoară la o temperatura de 10 - 50 ° C.
Presiunea este un factor în accelerarea reacției primare și factorul de compensare în echilibrul față de produsul dorit. Cu toate acestea, creșterea simultană a presiunii determină trecerea de echilibru de dimerizare la dreapta. creșterea presiunii excesive este impracticabilă deoarece duce la o creștere a costurilor de energie pentru comprimarea gazului, precum și formarea și precipitarea unui condensat de cantități semnificative de N2 O 4 și HNO3. În practică, funcționează la presiuni de 0.40-0.45 MPa. După ieșirea din gazele de reacție cuprind NO2 contact. N 2 O 4. O 2. N 2 O. NO. N 2 O 3. vapori de apă.
Timpul de contact și gradul de conversie. reacția de oxidare are loc spontan, fără acceleratori externe. În același timp, rezultatele globale viteza de reacție a treia comandă o scădere accentuată cu creșterea gradului de conversie. Prin urmare, ca un reactor de oxidare, folosind o unitate cilindric tubular, care funcționează în modul de deplasare. Când această reducere bruscă a vitezei cu creșterea gradului de conversie al reactanților permite să se încheie procesul de transformare a acestora. Prin urmare, se realizează la gradul optim de conversie de 92%. Această valoare corespunde să contacteze ori de ordinul a câteva secunde.
Raportul dintre reactanți trebuie să fie menținute în conformitate cu stoichiometria, adică, 2. 1. Acest lucru atinge productivitatea maximă a procesului.
Absorbția de dioxid de azot.
Toți oxizii de azot, NO cu excepția reacționează cu apa pentru a forma acid azotic. Absorbția oxizilor de azot cu apa care curge prin cele două makrostadii - dizolvarea naturală a gazelor în apă și interacțiunea lor chimică ulterioară cu apă, pentru a produce acid azotic și acid azotoase. acid nitros este un compus sunt instabile și se descompune în acid azotic, oxid de azot (II) și apă.
NO2 totală în reacție cu apa poate fi reprezentată prin ecuația
Formată înapoi oxidat NO la NO2
Dintre cele două makrostady - dizolvarea fizică și reacția chimică are loc mult mai rapid decât a doua și rata acesteia determinată de rata de transfer de masă a fazei gazoase în lichid. descompunerea acidului azotos este relativ lent. NO rezultat este parțial oxidat cu oxigen în soluție, dar cea mai mare parte din ea a reacționat cu oxigen în fază gazoasă conform reacției (13). Concomitent cu absorbția și reacția chimică în soluție în fază gazoasă, de asemenea, în parte, aceleași reacții apar conducând la formarea acidului azotic. În reacția NO2 și vaporii de apă în faza gazoasă formarea ceții acide.
Gradul de dioxid de absorbție prin soluții apoase de azot acid azotic este determinată de factori precum temperatura, presiunea de concentrare, acid. Atunci când temperatura este scăzută și concentrația de acid și presiunea crește rata de conversie a creșterilor de dioxid de azot. Atunci când concentrația de acid azotic de peste 65% absorbția încetează practic.
De asemenea, trebuie remarcat faptul că gradul de oxidare a NO depinde de capacitatea rămasă, iar cantitatea de oxizi de azot absorbit - suprafața de contact fază. Prin urmare, una dintre cerințele de bază pentru aparatul de absorbție - crearea volumului maxim nule în același timp, suprafețele absorbante foarte dezvoltate. Prin urmare, formarea reactorului de acid azotic - o coloană de absorbție cu plăci de sită sau kopachkovymi. Spațiul dintre plăcile acționează ca un oxidant cantitate majoră fază gazoasă a eliberat NO. Barbotarea unui nou strat lichid pe placă asigură un transfer de masă intensiv cu absorbția componentelor gazului de facilitare în fază gazoasă a amestecului și astfel formarea de HNO3 și oxidarea în fază lichidă a NO. volum suficient de mare a fazei gazoase între plăcile permite obținerea de grade înalte de NO în fază gazoasă de oxidare a NO2. putem presupune că în absorbția coloanei fluxurilor de transformare descrisă în următoarele ecuații brute:
Pentru îndepărtarea excesului de căldură pe tăvi instalate frigidere serpentine plate cu apă care circulă în ele.
plante moderne funcționează la presiune ridicată (0,2 la 1 MPa) proiectat pe schemele ehnergotehnologicheskih principiu în care energia gazelor de evacuare (asociate cu temperatura lor ridicată și presiune), și căldura reacției de oxidare a amoniacului, utilizat pentru comprimarea aerului și a gazelor de azot, precum și obținerea de abur tehnologic. Același circuit se asigură utilizarea mai completă a energiei de calitate inferioară. Diagrama de flux de proces formează un acid azotic diluat sub presiune crescută este prezentată în Figura 2
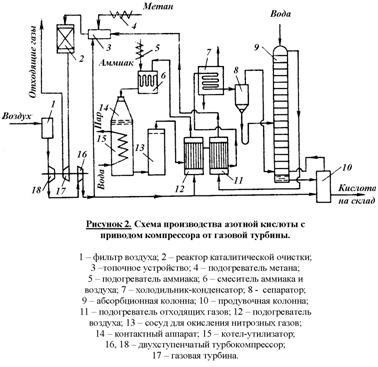
Fluxul principal de aer după comprimare este încălzit în preîncălzitor (12) până la 250-270 ° C, azot gaz și căldura furnizată amestecul cu amoniac în mixer (6).
1%. Prin urmare, acidul este direcționat către coloana de purjare (10), unde aerul încălzit din acesta a fost purjat de oxizi de azot, și purjate de acid dirijat spre depozitare. Aerul după coloana de purjare este alimentat în partea inferioară a coloanei de absorbție (9).
la lista de articole
la lista de prelegeri