Nitraturile de celuloză (NC) sunt baza energetică și structurală a pulberilor de celuloză nitrat și a combustibililor solizi.
Azotatul de celuloză se numește esteri de celuloză și acid azotic. Pentru producerea celulozei nitrat de celuloză utilizată fiind conținută în bumbac, lemnul, inul, paie și așa mai departe. P. Într-o cantitate de 92-93% (bumbac) și 50-60% (lemn). Pentru producerea de nitroceluloză de înaltă calitate se utilizează celuloză pură obținută din această materie primă prin tratament chimic special.
Molecula de celuloză constă dintr-un număr mare de resturi de glucoză identice și interconectate C6H10O5.
Prin urmare, formula generală pentru celuloză are forma (C6H10O5) n, unde n este numărul de resturi de glucoză.
În fiecare rest de glucoză, există trei grupări hidroxil -OH. Aceste grupări hidroxilice reacționează cu acidul azotic conform schemei:
,
unde m = 1; 2 sau 3.
În funcție de condițiile de nitrare, nu toate grupele hidroxil pot fi înlocuite, ci doar o parte din ele. Din acest motiv, nu se obțin una sau mai multe nitroceluloze cu grade diferite de esterificare.
Structura de celuloză nu poate exprima orice formulă special datorită faptului că este non-uniform în molecule de dimensiune. O și mai mare măsură se referă la un nitrat de celuloză, care sunt de asemenea compuse din molecule, gradul de esterificare neuniforma. nitrați de celuloză, în funcție de conținutul de azot (gradul de esterificare), solubilitate în amestec spirtoefirnoy și gradul de polimerizare este aproape clasificată în următoarele tipuri: piroxilină № 1, piroxilină № 2 piroxilină mixt marcheaza BA, CA, NA, pirokollody și colodiu diferite mărci : Н, ВНВ, ПСВ, КП
13. Perle de piroxilină utilizate în producția de n. De ce nu folosesc același tip de piroxilină, colloxilină. Explică.
Structura de celuloză nu poate exprima orice formulă special datorită faptului că este non-uniform în molecule de dimensiune. O și mai mare măsură se referă la un nitrat de celuloză, care sunt de asemenea compuse din molecule, gradul de esterificare neuniforma. nitrați de celuloză, în funcție de conținutul de azot (gradul de esterificare), solubilitate în amestec spirtoefirnoy și gradul de polimerizare este aproape clasificată în următoarele tipuri: piroxilină № 1, piroxilină № 2 piroxilină mixt marcheaza BA, CA, NA, pirokollody și colodiu diferite mărci : Н, ВНВ, ПСВ, КП.
piroxilină № 2 gonflează în întregime în amestec spirtoefirnoy și definește parțial soluția lichidă. Piroxilină № 1 gonflează numai parțial într-un solvent, dar fiind între particule solvate piroxilină № 2 devine mobil, t. E. Guncotton № 1 și 2 guncotton № interacționează nu numai cu solventul, dar, de asemenea, unele cu altele. Se constată că guncotton dizolvat № 2 este un plastifiant mai eficient pentru piroxilină № 1 decât spirtoefirnaya amestec.
Solubilitatea HC este cantitatea de HC care este transformată în soluție prin tratarea probei (1 g) cu un amestec de alcooli (150 ml)
cu un raport al componentei de 1: 2 (în volum).
Reducerea solubilității piroxilinei mixtă datorită reducerii conținutului de piroxilină nr. 2 conduce la o reducere a consumului de solvenți. Cu toate acestea, cu un conținut foarte scăzut de piroxilină nr. 2 în amestec, consumul de solvent crește de asemenea. Acest lucru se datorează faptului că guncotton rău № 1 spirtoefirnoy amestec plastifiat, deci este necesar să se mărească amestecul activității spirtoefirnoy prin creșterea conținutului în acesta din eter.
Potrivit lui Browns, piroxilinele cu azot mediu cu o solubilitate de aproximativ 40% au cea mai bună plasticitate la același consum de solvenți.
Principalul rol în umflarea piroxilinelor amestecate este jucat de piroxilina nr. 2. Unul dintre principalii parametri care determină comportamentul piroxilinei nr. 2 este gradul de nitrare.
Plastifianți ai nitraților de celuloză. Dacă nitrații de celuloză au fost capabile compactate la o densitate de 1600-1670 kg / m3 (1,60-1,67 g / cm3) și turnate sub comprimare în discuție, pulberea poate fi realizată dintr-un singur component - azotații de celuloză. Cu toate acestea, acest lucru este imposibil. Acest lucru se datorează lipsei proprietăților de plasticitate pentru nitrații de celuloză.
Ele sunt solide structura fibroasa, friabil, cu un număr mare de macro - și golurile micro umplute cu aer, și constau dintr-o macromoleculelor polare greu legate între ele, mai degrabă ferm diferite forțe (Interpacket și intermoleculară) și care nu sunt capabile de vedere deplasamentul unul față de celălalt. Ei nu au thermoplasticity chiar și la temperaturi ridicate și sunt în stare vitroasă.
Energia totală de legare dintre macromolecule de-a lungul întregii lor lungimi poate depăși cu mult energia de legare dintre legăturile individuale ale lanțului. Prin urmare, ruperea unei molecule de la alta este la fel de dificila ca ruperea macromoleculelor in legaturi separate.
Valoarea totală a energiei interacțiunii intermoleculare a NC este mult mai mare decât energia mișcării termice a legăturilor și a segmentelor macromoleculelor lanțului. Atunci când sunt încălzite, NC distrugerea legăturilor chimice are loc înainte de slăbirea totală a secundar (și Interpacket intermoleculară) obligațiuni vor fi suficiente pentru a asigura condițiile pentru trecerea de la substanța sticloasă în stare foarte elastic și vâscos.
Sa constatat că nici presiunea, temperatura, nici timpul de tratament al NC în presele de turnare nu le poate conduce la o stare plastică. Prin urmare, pentru a da NC acele proprietăți care ar determina fluiditatea sa sub influența forțelor externe de deformare, ele trebuie modificate.
Una dintre modalitățile de a modifica NC este plasticizarea. Aceasta constă în introducerea în polimer a diferitelor lichide și solide (plastifianți) pentru a facilita prelucrarea lor, precum și pentru a îmbunătăți elasticitatea materialului și a conferi rezistență la îngheț.
În timpul plastifizării, se modifică viscozitatea sistemului, crește flexibilitatea macromoleculelor și crește mobilitatea structurilor supramoleculare. Pentru coloxiline, pirocolid, piroxilină nr. 2, piroxiline de amestec, un plastifiant bun este un amestec de alcool etilic și eter dietilic. Trebuie remarcat faptul că, separat, alcoolul etilic și eterul dietilic nu sunt plastifianți ai NC.
Cel mai eficient plastifiant al tuturor NC (de la colloxiline la piroxile) cu cel mai înalt grad de esterificare este acetona și acetat de etil. Nitroglicerina, nitrodiglicolul sunt plastifianți buni ai colloxilinei. Plastifianții suplimentari sunt dinitrotoluenul, ftalatul de dibutil.
Când a adăugat la piroxilină amestec cantitate spirtoefirnoy adecvată masa obținută care este ușor deformat de forțe externe, dar, după ce sarcina este îndepărtată la starea inițială nu este returnat, t. E. În sistemul există o deformare reziduală mare datorită curgerii din plastic, care este cunoscută , este întotdeauna complicată de dezvoltarea deformării cu elasticitate ridicată.
15) Cel mai important este simplu, eter dietilic. formula care are următoarea formă: (C2H5) 20 sau C4H10O. Este un lichid volatil incolor, transparent, extrem de mobil, care are un miros deosebit și un gust arzător. Sub influența luminii, aerului, căldurii și umidității, eterul este capabil să se descompună, formând aldehide toxice, peroxizi și cetone, care irită tractul respirator. La o temperatură a apei de 20 de grade, se dizolvă cu 6,5%. Se amestecă bine cu uleiuri grase și esențiale, benzen și alcool, indiferent de raport. Eterul însăși, asemenea vaporilor săi, este ușor aprins. Într-o anumită proporție cu oxigenul sau aerul, perechile de dietileter utilizate pentru anestezie sunt explozive
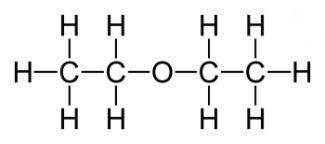
Proprietăți chimice Proprietățile chimice ale eterilor sunt caracterizate de eterul dietilic. Deci, vom aborda această problemă mai detaliat. Este o substanță destul de inertă. Principala diferență față de esteri este lipsa hidrolizei, dar există și excepții. În condiții de frig nu reacționează cu clorura de fosfor, sodiu metalic și mulți acizi minerali diluați. In ciuda acestui fapt, acizi puternici (sulfuric și iodhidric), chiar și la temperaturi scăzute, acești esteri sunt descompuse și încălzite prin scindează de sodiu metalic le. Esterul cu perechi de electroni singulară interactioneaza cu protonul unui acid tare, formând astfel un compus oxoniu instabil: - acidoliză. acidul sulfuric și acidul iodhidric și FeCl3 în anhidridă acetică capabilă să scindeze eteri. Reacția chimică este următoarea: CH3-CH2-O-CH2-CH3 + HJ → CH3-CH2-OH + J-CH2-CH3. - Reacția metalării, numită reacția Shorygin. Încălzite scindează de sodiu metalic dietil eter: C2H5-O-C2H5 + 2Na → C2H5ONa + C2H5Na - inerția chimică relativă nu împiedică esterii în timpul depozitării în aer pentru a forma peroxizi, care de multe ori duce la explozii la capătul de distilare.
Dietileter: proprietăți fizice miros ciudat, eteri punct de fierbere scăzut - dovada unui impact intermoleculare slab, iar acest lucru indică o polaritate și absențe scăzute precondiții pentru formarea de legături de hidrogen. Spre deosebire de alcooli, esterii au proprietăți mai puternice de donare a electronilor, ceea ce este confirmat de valoarea potențialelor de ionizare. Îmbunătățirea acestor caracteristici se datorează efectului inductiv pozitiv al grupului de atomi obținuți din alcani după îndepărtarea atomului de hidrogen.
Punctul de fierbere al dietil eterului este de 35,6 grade Celsius (este mult mai mic decât cel al alcoolilor izomerici) și punctul de îngheț este de 117 oC. Eterii aproape nu se amestecă cu apă. Explicația este destul de simplă: ei nu sunt capabili să formeze legături de hidrogen, deoarece moleculele lor nu au legături polare. Slab solubil în apă și eter dietilic, a cărui densitate față de oxidul de hidrogen este de 0,714. Una dintre trăsăturile substanței în cauză este tendința de electrificare. Probabilitatea apariției evacuărilor de electricitate statică este deosebit de ridicată la transfuzia sau descărcarea compoziției chimice, ca urmare a apariției aprinderii. Se formează vapori de aer cu aer, care este de 2,5 ori mai ușoare, amestecuri explozive. Limita explozivă inferioară este de 1,7%, iar limita superioară este de 49%. Lucrand cu eterul, nu trebuie sa uitam ca perechile sale au proprietatea de a se raspandi pe distante lungi fara a pierde capacitatea de a arde. Prin urmare, principala precauție este absența focului deschis și a altor surse de aprindere. Eter - compus slab activ, uneori mai puțin reactiv decât alcoolii. Se dizolvă remarcabil cea mai mare parte a materiei organice, datorită căreia se folosește ca solvent. Dietileterul nu este o excepție. Proprietățile fizice, precum și proprietățile chimice, îi permit să fie utilizate în medicină și producție
Prepararea eterului dietilic. Eterii nu se găsesc în natură - se obțin sintetic. Sub influența catalizatorilor acide asupra alcoolului etilic la temperatură ridicată, se obține eter dietilic (formula este indicată mai sus). Cea mai simplă modalitate de a obține această substanță este prin distilarea unui amestec format din acid sulfuric și alcool. Pentru a face acest lucru, trebuie să fie încălzit la 140-150 grade Celsius. Vom avea nevoie de alcool etilic și acid sulfuric (în proporții egale), pipete, tuburi de testare și conducte de gaz. Deci, după ce echipamentul și reactivii sunt pregătiți, puteți începe să efectuați experimentul. Într-o eprubetă (trebuie să fie neapărat uscată), este necesar să se toarnă 2-3 ml dintr-un amestec de alcool și acid și se încălzește lent. De îndată ce pornește fierberea, arzătorul este îndepărtat și se adaugă 5 până la 10 picături de alcool etilic la amestecul fierbinte prin intermediul unei pipetă de-a lungul peretelui tubului. Reacția care curge este după cum urmează: CH3-CH2-OH (acid etilsulfuric) + H2S04CH3-CH2-OS03H + H20; CH3-CH2-OS03H + CH3-CH3-0; CH3-CH2-O-CH2-CH3 (dietil eter) + H2S04. Formarea eterului dietilic este evidențiată de mirosul care a apărut.
Compoziție și formulă Etanolul - exact așa cum se numește unul dintre numele său oficial - se referă la alcooli simpli. El cunoaște aproape toată lumea sub unul sau altul dintre nume. Adesea se numește pur și simplu alcool, uneori se adaugă adjective "etil" sau "vin", chimistul poate numi și metil carbinol. Dar esența este una - C2H5OH.
Proprietati fizice si chimice Etanolul are toate caracteristicile si reactiile generale ale alcoolilor. Este incolor, are un gust și un miros caracteristic. În condiții normale, este lichid, trece într-o formă solidă la o temperatură de -114 ° C și se fierbe la +78 grade. Densitatea alcoolului etilic este de 0,79. Este bine amestecat cu apă, glicerină, benzen și multe alte substanțe. Se evaporă cu ușurință, așa că trebuie depozitat în recipiente bine închise. Este singurul solvent excelent și are, de asemenea, proprietăți antiseptice excelente. Foarte inflamabil atât în stare lichidă, cât și în stare de vapori. Etanolul este o substanță psihoactivă și narcotică, face parte din toate băuturile alcoolice. O doză letală pentru un adult este de 300-400 mililitri dintr-o soluție de alcool 96% consumată timp de o oră. Această cifră este mai degrabă arbitrară, deoarece depinde de un număr mare de factori. Pentru copii, suficiente deja 6-30 mililitri. Deci, etanolul este o otravă eficientă. Cu toate acestea, este utilizat pe scară largă deoarece are o serie de proprietăți unice care o fac universală
Prepararea eterului dietilic. Eterii nu se găsesc în natură - se obțin sintetic. Sub influența catalizatorilor acide asupra alcoolului etilic la temperatură ridicată, se obține eter dietilic (formula este indicată mai sus). Cea mai simplă modalitate de a obține această substanță este prin distilarea unui amestec format din acid sulfuric și alcool. Pentru a face acest lucru, trebuie să fie încălzit la 140-150 grade Celsius. Vom avea nevoie de alcool etilic și acid sulfuric (în proporții egale), pipete, tuburi de testare și conducte de gaz. Deci, după ce echipamentul și reactivii sunt pregătiți, puteți începe să efectuați experimentul. Într-o eprubetă (trebuie să fie neapărat uscată), este necesar să se toarnă 2-3 ml dintr-un amestec de alcool și acid și se încălzește lent. De îndată ce se pornește fierberea, arzătorul este îndepărtat și se adaugă 5 până la 10 picături de alcool etilic la amestecul fierbinte prin intermediul unei pipetă de-a lungul peretelui tubului. Reacția care curge este după cum urmează: CH3-CH2-OH (acid etilsulfuric) + H2S04CH3-CH2-OS03H + H20; CH3-CH2-OS03H + CH3-CH3-0; CH3-CH2-O-CH2-CH3 (dietil eter) + H2S04.