În viața obișnuită auzim destul de des cuvântul electroliză. Dar, nu toată lumea știe ce înseamnă.
Electroliza este un proces fizico-chimic. În cursul căruia trece un curent electric constant prin electrolit. În timpul electrolizei, un electrod încărcat pozitiv are anodul de nume. A, încărcat negativ - catodul. Mutarea particulelor în electrolit sunt numite ioni. În timpul procesului de electroliză, cationii ionici pozitivi - se deplasează la catod, ionii negativi - anioni - se deplasează la anod.
Cel mai adesea în viața obișnuită, cuvântul electroliză înseamnă electroliza apei. Acesta este un proces în care apa este descompusă în hidrogen și oxigen prin intermediul unui curent electric. Și este descrisă de următoarea reacție chimică.
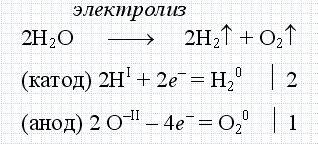
Procesul de electroliză este foarte utilizat pe scară largă în inginerie și industrie. De exemplu, exclusiv, cu ajutorul electrolizei, se produce astăzi aluminiu. De aceea, această producție este asociată cu costuri mari de energie.
Principalele legi fizice care descriu electroliza sunt legile lui Faraday.
În 1832, Faraday a stabilit că masa m a materiei eliberată la electrod este direct proporțională cu sarcina electrică q care a trecut prin electrolit:
dacă un curent constant este trecut prin electrolit pentru un timp t cu o forță curentă de I.
Coeficientul de proporționalitate
k se numește echivalentul electrochimic al substanței. Este numeric egal cu masa substanței eliberate atunci când o sarcină electrică trece prin electrolit și depinde de natura chimică a substanței.
Această lege a fost numită Prima lege a lui Faraday.
A doua lege a lui Faraday:
Echivalentul chimic al unui ion este raportul dintre masa molară A a ionului și valența lui z. Prin urmare, echivalentul electrochimic.
A doua lege a lui Faraday este scrisă în următoarea formă:
unde
M este masa molară a substanței formate (dar nu neapărat izolată - ar fi putut intra în orice reacție imediat după formare) ca urmare a electrolizei, g / mol;
I este puterea curentului trecut prin substanța sau amestecul de substanțe (soluție, topire), A;
t este timpul în care a fost efectuată electroliza;
F - constantă Faraday, Cl-mol-1;
n - numărul de electroni implicați în procesul care la valori suficient de mari de curent egală cu valoarea absolută încărcare a ionului (și contraionul acestuia), să ia parte la electroliza (oxidat sau redus). Totuși, acest lucru nu este întotdeauna cazul; de exemplu, în electroliza unei soluții de sare de cupru (II), pot fi formate nu numai cupru liber, dar și ioni de cupru (I) (la putere redusă de curent).