<<Степень окисления
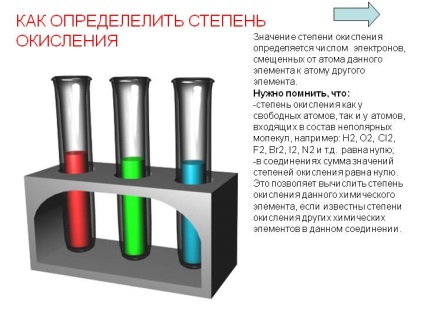
Cum se determină gradul de oxidare. Valoarea gradului de oxidare este determinată de numărul de electroni deplasați de la atomul unui element dat la atomul altui element. Trebuie să ne amintim că: - gradul de oxidare atât la atomii liberi, cât și la atomii care fac parte din moleculele nepolare, de exemplu: H2, O2, Cl2, F2, Br2, I2, N2 etc. este egal cu zero; În compuși, suma gradelor de oxidare este zero. Acest lucru permite calcularea gradului de oxidare a elementului chimic, dacă se cunoaște oxidarea altor elemente chimice din compus.
Slide 12 din prezentarea "Valence și gradul de oxidare" la lecții de chimie despre "Legarea chimică"
Dimensiuni: 720 x 540 pixeli, format: jpg. Pentru a descărca un diapozitiv gratuit pentru utilizare în lecția de chimie, faceți clic pe imagine cu butonul din dreapta al mouse-ului și faceți clic pe "Salvare imagine ca." “. Descărcați întreaga prezentare "Valence.ppt" poate fi în mărimea zip-arhivă de 736 KB.
Legarea chimică
"Gazele inerte" - Radon. Lampa Xenon. Schema atomului de heliu. Simbolul elementului, realizat din tuburi cu descărcare în gaz, umplute cu heliu. Xenon. Heliu. În acel moment, ei nu știau că heliul era un gaz inert și se presupunea că era metal. Heliul conduce un grup de gaze inerte în tabelul periodic. Argon. Fluorurile xenonului sunt otrăvitoare.
"Ligand" - Ilya Repin. FA Cotton, J. 13. Exemple de liganzi. Henri Poincaré. Tabele de elemente. Liganzii. K3 [Fe (CN) 6]. Portretul lui D. I. Mendeleyev în mantia doctorului de drept al Universității din Edinburgh. 1885. 4. Izomerismul CS izomerismului geometric. Sfera interioară. Coenzima este vitamina B12. 7.
"ЕГЭ по химии" - Pregătirea pentru UTI în chimie. Chimie generală în teste, sarcini, exerciții. 11 clasă. Componentele esențiale ale cursului. Chimie. 10 clasă. Chimie organică în teste, sarcini, exerciții. 10 clasă. Ajutoare de instruire. Utilizarea cursurilor în procesul de învățare. O. S. Gabrielyan, FN Maskaev, S. Yu. Ponomarev, V. I. Terenin.
"Electroni și atomi" - Core (1,67 • 10-27 kg). Energia ionizării atomilor elementelor din a doua și a treia perioadă. "Descoperire" a electronului. " Lățimea laterală (orbitală) l - determină ... Creșterea razei atomice efective, cat. Se mărește nonmonotonic. 4. Electronegativitate. (4 + 0).
"Proprietăți chimice" - Structura atomului. Clase de compuși anorganici. Cu privire la efectul termic. Indicatori. Fenomenele chimice (reacții chimice). Relația genetică între clasele de compuși anorganici. Numărul perioadei arată numărul de niveluri de energie din atom. Fiecare perioadă începe cu metale alcaline și se termină cu elemente inerte.
Total în tema "Legătura chimică" 23 prezentări