Rafinarea - purificarea metalelor prețioase din impurități și separarea acestora în comportamentul nostru la instalațiile centralizate care dispun de echipamente și condiții pentru realizarea redistribuirii necesare cu pierderi reduse.
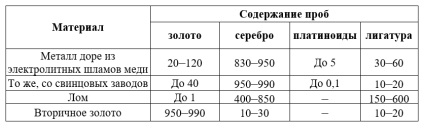
În rafinării și intră în aur nativ schlich alocate la gravitațional și minereu de pansament aur aluvionar din amalgame de nămol metalic din electroliza cuprului Dore și producerea de deșeuri de plumb. Aici sunt procesate deșeurile industriale și menajere, aliaje vechi monede realizate din materiale reciclate, precum și alte materiale.
În plus față de aur și argint, al căror raport masic este foarte diferit, în materiile prime se găsesc metale de platină, precum și cupru, plumb, antimoniu, fier, staniu, bismut și alte impurități.
Loturile individuale de materii prime sunt deseori mici în masă și eterogene, astfel încât pentru a calcula mediile și a clarifica calculele cu furnizorii, se utilizează arderea în cuptoare de inducție și lingourile sunt testate.
Pentru a separa ligatura și argintul, aliajele lichide din aceleași cuptoare în creuzete de grafit sunt purjate cu clor. Toate metalele sunt clorurate, clorurile sublimate, dar se dizolvă în principal în zgură, pentru formarea primară a căruia sunt încărcate borax, sifon și nisip. Conform datelor prezentate mai jos privind potențialul izobaric de formare a clorurilor la 1200 ° C și punctele lor de fierbere, este posibilă estimarea aproximativă a cursului de clorurare:
Mai întâi, clorurile elementelor de ligatură, apoi AgCl și, în final, AuCl3, se sublimează și trec în zgură. La prima apariție a semnelor de clorurare a aurului, purjarea este oprită, metalul a 995 de eșantioane este turnat în matrițe și depozitat în fondul valutar sau purificat suplimentar prin electroliză, așa cum este descris mai jos. Acesta din urmă este întotdeauna necesar cu conținutul de platinoizi.
Zgura de clorură constă în principal din AgCl și CuCl, este zdrobită, încărcată în pungi, care sunt apoi plasate într-o baie cu acid sulfuric diluat împreună cu foi de fier. Argintul este apoi redus cu ioni de Fe 2+:
AgCl + Fe 2+ = Ag + Fe 3+ + CI,
clorura de cupru este oxidată
CuCI + Fe 3+ = Cu2 + + Fe2 + + Cl.
Prin penetrarea țesutului pungilor, Cu 2+ este cimentat cu fier. Fe 3+ sunt de asemenea reduse cu fier, deci sunt foarte mici în soluție și echilibrul reacției de reducere a argintului cu fier este deplasat spre dreapta. O reducere suficient de completă a argintului se realizează în două zile la o temperatură de soluție de 90-100 ° C.
Precipitatul argintului de ciment este presat, topit și turnat în anozi de 10 kg sub formă de plăci cu grosimea de aproximativ 10 mm, nu ar trebui să existe mai mult de 200 de probe de aur și 75 de eșantioane din aliajul principal.
Electroliza argintului
Electrolitul este o soluție de AgNO3 cu o activitate de 1 mol / l (până la 100 g / l Ag).
Când dizolvarea anodelor, argintul, cuprul, plumbul, bismutul și alte impurități trec în soluție. Aurul cade sub formă de nămol praf, care conține metale de platină, seleniu, telur, sulf și alte impurități care sunt insolubile în electrolit.
Bazele catodului sunt realizate din foi subțiri de argint sau aluminiu.
Sediul catodic de argint are o structură liberă cristalină; Este ușor de curățat de pe baza catodului și cade la baza băii. Pentru a se asigura că precipitatul de argint pur și nămoluri de aur nu sunt amestecate, anodele sunt plasate în saci de țesături.
Anozi aproximativ 10 mm grosime, se dizolvă aproximativ peste zile, după care reziduul nedizolvat este reciclat topirea nămolului anod acoperă aur evacuate, iar din partea inferioară a aluminiului baie scafe perforat recuperate cristalele sunt din argint pur.
densitatea de curent nu trebuie să depășească 400-600 A / m 2, este necesar să se agite puternic electrolit și nu permite acumularea considerabilă de impurități, în principal, din cupru, care să evite contaminarea unui depozit catodic trebuie să fie nu mai mult de 4-5% în soluție.
Dacă aurul este mai mult de 200 de probe, acesta trece prin anozi și începe oxigenul, iar tensiunea pe baie crește în consecință.
Băile cu o capacitate de până la 0,6 m 3 sunt realizate din viniplast și sunt întărite cu cadre din lemn sau fier. Temperatura electrolitului de aproximativ 40 ° C este menținută de căldura generată de curent. Pentru a se amesteca, soluția este agitată cu aer. Tensiunea pe baie, în funcție de compoziția electrolitului și densitatea curentului de 0,8-2,6 V, consumul de energie de 300-600 kW • h / t.
Depunerea de argint după spălare cu acid azotic diluat, apă și remodelare are o puritate de 999,9 probe. Pentru consumatori individuali, prin electroliza repetată, se obține un metal de 999,99 sau 999,999 probe.
Electrolitul uzat este epuizat în argint în băi separate cu anozi din aliaje de calitate inferioară.
Electroliza aurului
Electroliza este furnizată de metal după clorurare și suspensii din electroliza argintului, supusă în prealabil purificării chimice în mai multe etape. Toate acestea se topesc în cuptoare de inducție și se toarnă în anozi rectangulare cu o masă de 2-3 kg. Anodii sunt contaminați cu argint, metale de platină și ligatură relativ mică.
Electrolitul este o soluție de HAuCl4 și HCI (până la 200 g / l Au și 80 g / l HCI). Aurul se dizolvă în funcție de reacții:
Au + 4Ci-3e = AuCi-4; E ° = 0,93 V,
Au + 2Cl - - e = AuCi - 2; E ° = 1,11 V.
Apariția ionilor de AuCl-2 este posibilă datorită polarizării concentrației la o densitate ridicată a curentului sau datorită formării unei turte AgCl la anod; Totuși, ele se dispersează imediat cu precipitarea metalului care precipită în nămol:
Cu aciditate și temperatură insuficiente, anodele de aur sunt pasivate, dizolvarea lor încetează și începe evoluția clorului
Oxigenul nu este eliberat din cauza supraexpirării acestuia pe aur.
Electroliza se efectuează la 50-60 ° C. Platina și paladiul se dizolvă și se acumulează în electrolit:
Pd + 4CI-2e = PtCl2-4; E ° = 0,62 V.
Componentele ligaturilor: cupru, plumb, bismut, fier, staniu, antimoniu și alte metale formează ioni simpli sau cloruri complexe, de obicei nu cauzează dificultăți în dizolvarea anodului. Fier, care trece în soluție ca Fe 2+. restabilește aurul, mărind tranziția la nămol:
AuCl - 4 + 3Fe2 + = Au + 3Fe3 + + 4CI -.
Argintul dă clorură insolubilă.
Dacă aliajul are mai puțin de 50 de probe de argint, clorura nu provoacă complicațiile sale. Cu un conținut mai mare, AgCl acoperă anodul cu o crustă mai fermă, mai mult sau mai puțin densă, împiedicând dizolvarea aurului.
Conform metodei Volvil, este posibilă dizolvarea anodelor de aur, în care există până la 200 de probe de argint, folosind un curent asimetric. Pentru a face acest lucru, împreună cu o constantă - printr-o baie trece aproximativ egală cu ea în vigoare curent alternativ.
Probabilitatea de contaminare a depunerii catodului cu impuritățile este scăzută; Cu toate acestea, este posibilă depunerea, împreună cu aur, a platinei și a paladiului, în special la densitatea ridicată a curentului. Evitați acest lucru, nu permiteți creșterea concentrației de platină mai mare de 50 g / l și paladiu mai mult de 15 g / l. Alte impurități în soluție care conțin nu mai puțin de 100 g / l de aur, nu trebuie să fie mai mari de Cu 90 g / l; Pb 1,5 g / l; Acele 4 g / l și 2% Fe.
Electrolitul uzat este epuizat în aur în băi separate cu anozi de grafit, după care aurul și platina sunt izolate de el în moduri diferite.
Electroliza aurului se realizează în porțelan mai rar în băi de viniplastovyh cu o capacitate de 25 de litri. Anodii cu număr total, de exemplu 15, sunt suspendați pe tije de argint trei rând, pe fiecare rând, un catod comun este plasat dintr-o folie de aur ondulat de 0,2 mm grosime. Băile sunt instalate în băi de apă, electrolitul este agitat cu aer.
Densitatea totală de curent continuu și curent alternativ până la 1500 A / m 2. Tensiunea celulei de circa 1 V. Puritatea peletului catodului după periere mecanică și apoi spălare cu acid clorhidric și amoniac 999,9.