O etapă importantă a oricărei metode imunohistochimice este reprezentarea rezultatelor reacției "antigen-anticorp". Identificați anticorpi care se leagă la antigen, folosind diferite etichete asociate cu fragmentul Fc al anticorpilor. Aceste etichete pot fi:
Cu toate acestea, etichetele fluorescente au dezavantaje:
Prin urmare, s-au dezvoltat metode suplimentare de obținere a petelor stabile, astfel încât preparatele să poată fi examinate prin microscopie ușoară convențională și stocate pentru o lungă perioadă de timp.
Eticheta cea mai simplă pentru obținerea medicamentelor cu o durată lungă de depozitare sunt metalele, de exemplu, aurul coloidal. Ca urmare a reacției "antigen-anticorp", se găsește o culoare închisă în locul acumulării de anticorpi într-un microscop luminos. Pentru o lungă perioadă de timp, anticorpii metalici marcați rar utilizate datorită sensibilității reduse, dar în 1989 sensibilitatea godu a crescut cu 100 de ori prin metoda de amplificare cu argint și microscopie cu lumină polarizată [7]. În cazuri rare, anticorpii marcați cu metale grele sunt utilizați pentru examinarea ulterioară cu microscopie electronică a medicamentelor.
Radioizotopii sunt de asemenea utilizați foarte rar datorită riscului ridicat de expunere la personal. Anticorpii radiomarcați sunt utilizați în prezent numai pentru studii privind culturile de celule vii. După procesarea culturii de țesut cu anticorpi cu etichete radioactive, cantitatea de antigen căutat în țesuturi poate fi evaluată după gradul de radiație.
Cele mai utilizate etichete enzimatice [4]. O moleculă a enzimei, conjugată cu anticorpul, este capabilă să "trateze" un număr mare de molecule de substrat, colorantul insolubil rezultat se acumulează în țesutul din jurul anticorpului fixat la antigen.
Tabelul 1. Caracteristicile celor mai frecvent utilizate fluorochromi.
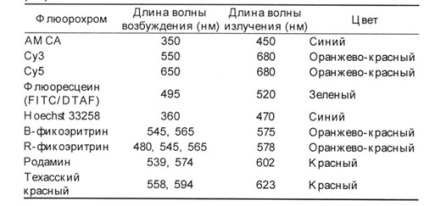
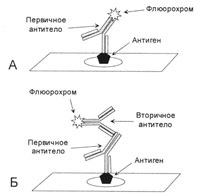
Figura 1. Metoda vizuală indirectă și vizuală
A - anticorpul primar împotriva antigenului conține o etichetă, de exemplu, un fluorocrom. B - anticorpul primar împotriva antigenului nu are etichetă, după incubarea cu anticorpul primar, se adaugă un anticorp secundar care se combină cu anticorpul primar. Eticheta se află pe anticorpul secundar.
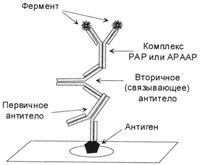
Figura 2. Complexul final format prin metoda PAP.
Anticorpul primar și anticorpul anti-peroxidază din complexul PAP trebuie să fie obținute de la animale din aceeași specie.
Cel mai frecvent utilizat ca etichetă enzimatică a fost peroxidaza de hrean, care a fost folosită pentru prima dată de Nakane și Pierce, fosfatază alcalină și oxidază de glucoză. Pentru fiecare dintre aceste enzime, există mai multe substraturi care, sub acțiunea enzimei, formează coloranți insolubili de diferite culori. Combinațiile posibile de enzime și substraturi sunt rezumate în Tabelul 2.
Trebuie amintit faptul că peroxidaza și fosfataza alcalină există în țesuturile corpului, astfel încât să puteți obține, uneori, un fals-pozitive rezultate [2,3]. Peroxidaza găsește în cantități mari în neutrofile și eozinofile, de aceea, pentru colorarea frotiurilor de sânge, măduvă osoasă și felii de organe imune utilizare a acestei enzime nu este recomandată. Atunci când se pictează alte țesuturi, o mică activitate a peroxidazei este blocată prin adăugarea de peroxid de hidrogen înainte de incubarea cu anticorpi primari. Fosfataza alcalină este prezentă în multe țesuturi, astfel încât în timpul incubării cu substratul este adăugat levamisol, dar trebuie să ne amintim că fosfataza alcalină intestinală, iar placenta nu este inhibată de levamisol, astfel încât aceste țesuturi este mai bine să se utilizeze alte enzime. Glucozoxidaza poate fi utilizată fără restricții la vopsirea oricărui țesut, deoarece în țesuturile mamiferelor nu există o astfel de enzimă.
Descoperirea etichetelor enzimatice a reprezentat un mare pas inainte in dezvoltarea tehnologiilor imunohistochimice, dar toate problemele nu au fost rezolvate. În studiul antigenelor, care sunt conținute în cantități mici în celule (de exemplu, receptorii hormonilor de pe suprafața celulară, canalele de ioni), sensibilitatea acestor sisteme a fost evident inadecvată.
Următorul pas în dezvoltarea sistemelor de formare a imaginii au devenit un sistem care utilizează anticorpi împotriva peroxidaza și fosfataza alcalină (PAP și APAAP complexelor). Secvența procedurii este după cum urmează. Etapa 1: Anticorpii primari sunt aplicați pentru prima dată; Etapa 2: Se aplică anticorpul secundar împotriva primar (anticorp liant), în care unul dintre siturile de anticorp secundar de legare la antigen se leagă la anticorpul primar, iar al doilea este încă liber; Etapa a 3: a făcut anticorpi împotriva peroxidaza sau fosfataza alcalină obținută de la un animal din aceeași specie de la care au primit anticorp primar, situsuri care sunt ocupate de către enzima corespunzătoare de legare. Acești anticorpi se leagă la al doilea situs de legare a antigenului al anticorpilor secundari (de legare). Astfel, un complex în care un antigen sunt legate de molecule de enzime au două (2), care crește sensibilitatea metodei de 2 ori.
O descoperire reală a fost dezvoltarea, în 1979, a unei metode de imunozălzire indirectă utilizând un complex biotin-avidină [5,6].
Tabelul 2. Enzimele utilizate în tehnicile imunohistochimice și substraturile corespunzătoare acestora.
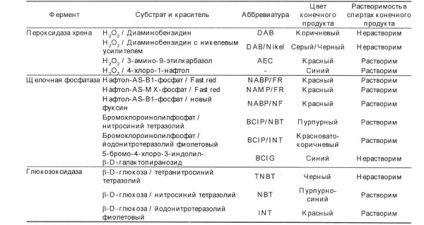
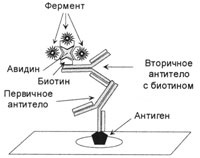
Figura 3. Complexul final cu metoda ABC
Complexul este format în trei etape. In corpul principal nemarcată primul pas conectat la un antigen, într-o a doua etapă anticorpii secundari marcați cu biotină sunt conectate la primar, acesta se adaugă la al treilea complex avidin-biotin-enzima care este atașat la anticorp secundar biotină.
Biotina este o vitamină H, formula chimică a acesteia este prezentată mai jos:
Biotina - un compus care este rezistent la temperaturi ridicate, la mediu acid și alcalin, se dizolvă bine în apă și alcool. Este o coenzima în multe reacții de adiție (carboxilare). Biotina poate intra ușor într-o legătură stabilă cu diferite proteine, inclusiv enzime și imunoglobuline. Un număr mare de biotina conținută în proteinele ou aviare, în cazul în care aceasta este legată de glicoproteină avidin având o greutate moleculară de 68 kDa. Avidinul formează un complex extrem de stabil cu biotină (KA = 1015 mol-1). Distrugerea unui astfel de complex este posibilă numai cu procesarea temperaturii, tk. Avidin este distrus prin încălzire. În plus, avidina are 4 situsuri de legare la care pot fi atașate biotină sau proteine. Astfel, complexul biotin-avidină poate fi utilizat ca o punte între anticorpi și enzime. Pentru aceasta, se prepară un complex constând dintr-o enzimă legată de biotină și avidină. În complexul format, cele trei situsuri de legare ale avidinei sunt legate prin biotină cu o enzimă sau fluorocrom, iar a patra rămâne liberă (Figura 3). După incubarea cu anticorpi secundari legați la biotină, se adaugă complexul avidin-biotină-enzimă. Astfel, cu o moleculă a antigenului, trei molecule ale enzimei sunt legate. Această metodă a fost numită metoda ABC (abrevierea complexului macro-molecular de limfocit de peroxidază de hrean). Din păcate, această metodă are dezavantaje, deoarece avidin se leagă la endogen biotina, care este într-o cantitate mare în ficat și rinichi, și de asemenea, acesta poate fi conectat cu lectine și încărcată grupuri în țesuturi, ca avidina are o sarcină, ea izoelekticheskaya minciuni în regiunea de pH 10,0.
Această tehnologie a fost dezvoltată în continuare după înlocuirea avidinului cu streptavidin, o proteină cu o greutate moleculară de aproximativ 60 kDa, obținută din microorganismele Streptomyces avidinii (metoda SaBC). Streptavidinul are aceeași capacitate de a lega biotina, cum ar fi avidina, spre deosebire de aceasta, nu are o sarcină într-un mediu neutru, nu se leagă de enzimele endogene și mult mai puțin de biotina endogenă. Înlocuirea avidinei cu streptavidin a făcut posibilă reducerea bruscă a colorării de fundal și creșterea sensibilității metodei cu aproximativ 8 ori.
Tabelul 3. Sisteme de vizualizare a antigenelor celor mai cunoscute firme