Pagina 2 din 32
CAPITOLUL 1
ANATOMIA SISTEMULUI DE CONDUCERE ȘI ELECTROFIZIOLOGIA INIMII
Anatomia sistemului de conducere al inimii. Sistemul inimii conductive include CS, tracturile interstițiale, nodul AV, pachetul His și ramurile acestuia, fibrele Purkinje și miocardul ventricular (Figura 1). SU este situat în vena cavă superioară și compusul atriul drept, capul se află mai aproape de epicardului, coada este situat în subendocardiace din partea superioară a atriului drept.
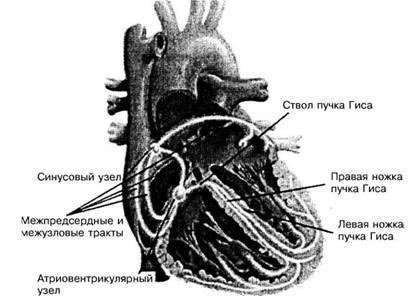
Fig. 1. Sistemul conductiv al inimii
În CS, există 4 tipuri de celule: celule N, celule P (pale palide), având activitate de stimulator cardiac; celulele T intermediare care conduc un puls la miocardul atriului drept; celulele tipice ale miocardului contractil, ele fără limite clare penetrează marginile nodului și trec în celulele T.
CS este furnizat cu "arterele SS", în 61% din cazurile care părăsesc artera coronariană dreaptă, în 39% - din stânga.
Căile inter-nod (căi intracirculatorii). Traseele frontale, medii și spate se disting. calea frontală este format din două ramuri, una dintre care este ghidat în atriul stâng (bundle Bachman), celălalt merge în partea de sus a unui compus AB pe partea din spate a septului interatrial. Calea de mijloc (un pachet de Wenkebach) trece de la CS la articulația AV pe partea posterioară a septului interatrial. Cel mai lung - spate calea sinoatrioventrikulyarny (Toreli fascicul) pornește de la SS, trece peste sinusul coronarian și fuzionează cu partea de jos a conexiunii AV. Conform sistemului de conducere al atriumului, pulsul trece de două ori mai rapid decât în țesutul muscular.
Amestecul AV este situat în partea dreaptă a septului interatrial, în partea inferioară a acestuia, deasupra locului de atașare a prospectului interior al supapei tricuspice. Din poziția de morfologie, conceptul de "nod AV" este cel mai potrivit, din poziția de electrofiziologie și clinică - termenul "conexiune AV" este mai acceptabil. Lățimea sa este de 4 mm, lungimea - 6 mm, grosimea - 1,5 mm. Conține celulele stimulatoare ale stimulatorului și celulele care conduc un impuls. Impulsurile pot fi efectuate cu aceeași viteză atât în direcția ventriculilor (anterograd), cât și invers (retrograd). În funcție de proprietățile funcționale ale compusului AV, există 4 diviziuni: o zonă a celulelor de tranziție; nod compact AV; Partea penetrantă a nodului AV; ramificație a nodului AV. Primele două diviziuni sunt partea atrială a articulației AV, celelalte două sunt ventriculare. Atriul este situat la baza septului interatrial, în principal pe suprafața dreaptă a inelului central fibros.
nodul AV Compact este situat în interiorul triunghiului Koch, anatomica regiune bine distinse ale cărei granițe alcătuiesc tendon Todaro, tebeziev valva sinusului coronarian și annulus valvei tricuspide (Fig. 2).
Într-un nod compact, se disting trei grupuri principale de celule: celulele AN sunt localizate pe periferie, celulele N sunt în centru, celulele NH sunt la limita cu porțiunea de penetrare a mănunchiului. Funcțional, zona cea mai importantă este AN, unde are loc întârzierea fiziologică a pulsului. Celulele stimulatoare cardiace sunt cele mai active în zona NH. Funcția principală a conexiunii AV este protejarea miocardului de impulsuri super-frecvente, care pot apărea în structurile supraventriculare ale inimii.
Alimentarea cu sânge a articulației AV este asigurată de "artera nodului AV", care se extinde în 83% din cazurile din artera coronară dreaptă, 7% din partea stângă și 10% din ambele.
Legătura lui, ramurile lui, fibrele lui Purkinje. Legătura din Hyis este o continuare a conexiunii AV, totuși tranziția nodului compact la pachetul lui Guis este atât de imperceptibilă încât este imposibil să se determine morfologic locul tranziției directe a unei formări în alta. Lungimea pachetului este de 15-20 mm, lățimea 1-4 mm. Partea sa penetrantă (10 mm) trece prin corpul fibros central (închis în țesutul fibros) în MZV în apropierea celor atrioventriculare
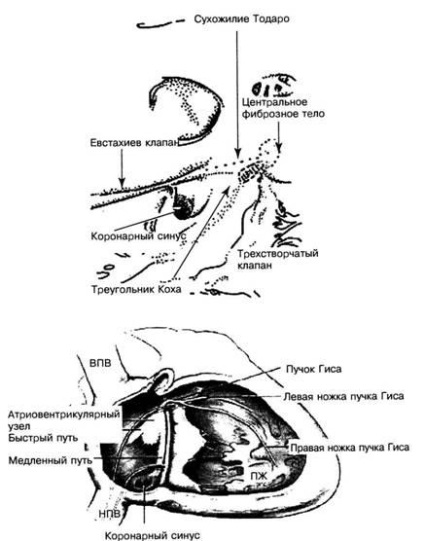
Fig. 2. Structura triunghiului Koch
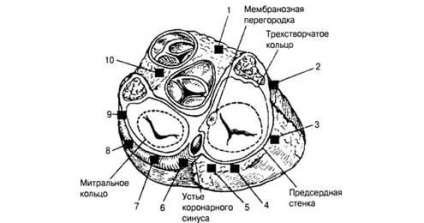
Fig. 3. Localizarea modalităților suplimentare de conducere. Secțiunea transversală a inimii la nivelul inelului fibros: 7 - septal anterior drept; 2 - față dreapta; 3 - lateral drept; 4 - spate drept; 5 - paraseptal drept; 6 - paresisal posterior stâng; 7 - spate stânga; 8 - stânga laterală; 9 - față stângă; 10 - paresisal față stângă
inele. Apoi, fasciculul se deplasează de-a lungul marginii superioare a părții musculare a IVF, formând un segment de ramificare sub forma picioarelor drepte și stângi. Limitele părții ramificate a mănunchiului sunt inelul fibros al supapei tricuspide (din spate) și capătul ramurii stângi a mănunchiului mănunchiului (din față). Piciorul drept al mănunchiului Său este îndreptat înainte și în jos spre straturile interioare ale jumătății drepte a FIV și a ventriculului drept. Piciorul stâng fiind o continuare a fasciculului His, ajunge subendocardică din jumătatea din stânga a septului interventricular și ventriculul stâng și este împărțit în două sau trei ramuri principale: partea din față, care se potrivește la baza mușchiului papilar anterior; Înapoi - se apropie de mușchiul papilar posterior. În 60% din cazuri, este format dintr-o a treia ramură a stânga picioare bloc de ramură - sredneseptalnaya - din diviziunea porțiunea piciorului stâng al spațiului pe ramura principală la mijlocul septului interventricular. Legătura finală a sistemului conductor este fibrele Purkinje, care se află în straturile subendocardice ale celor două ventricule și se leagă direct de celulele miocardului contractil.
Moduri suplimentare de conducere (Figura 3). Puls din SU poate fi distribuite nu numai prin conexiunea AV, dar și prin căi anatomică suplimentare separate: viteza de propagare a DPP semnificativ mai mare decât pentru conexiunea AV, care creează premise pentru activarea timpurie a zonelor în care calea de extensie de capăt. Anterior excitarea ventriculelor inimii a fost numită pre-excitație.
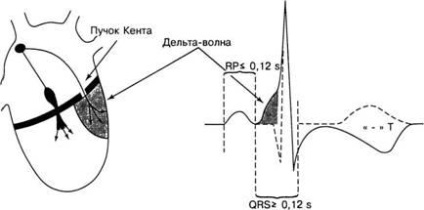
Fig. 4. Formarea semnelor electrocardiografice ale fenomenului WPW: intervalul PQ scurtat; un complex QRS extins și un val delta; deformarea segmentului ST și a unui dinte negativ T
Banda Kent este o punte musculară identică structural cu miocardul atrial, măsurând de la 1 la 8 mm. Se extinde prin canalul atrioventricular și se introduce în miocardul ventriculului. Pot exista mai multe pachete de Kent. Această piesă (e) snop (scripeți) peretele liber al atriului și ventriculelor (fasciculelor parietale) sau legăturile (dizolvate) partițiile interchamber atrii și ventricule (grinzi septale). Aceasta conduce la o imagine electrocardiografică a fenomenului WPW (Figura 4).
Tractul James este o formare a mușchiului care provine din secțiunile posterioare ale septului interatrial și deplasează nodul AV. Acesta este introdus într-un sistem de conducere specializat la nivelul părții distanțate a nodului AV sau a părții proximale a mănunchiului. Prezența acestui tract subliniază fenomenul PQ trunchiat.
Fibrele Maheheim conectează partea distală a nodului AV sau a părții proximale a mănunchiului cu secțiunile superioare ale IVF.
Electrofiziologia inimii este baza ionică a activității electrice a inimii. Conceptele de bază ale electrofiziologiei inimii includ potențialul de odihnă
Partea principală a ionilor K + intracelulari este în stare liberă, iar coeficientul său de difuzie este doar puțin mai mic decât cel al ionilor K + din spațiul extracelular. Prin urmare, ionii K + tind să părăsească celula, iar ionii Na + intră în celulă. Pompa de potasiu de sodiu pompează în mod activ ionii K + și Na + împotriva gradientilor lor electrochimici și astfel sprijină PP. Activitatea pompei de sodiu-potasiu este influențată de starea membranei celulare reprezentată de un strat de molecule de fosfolipide închise între două straturi de proteine adsorbite. Pompa de sodiu de potasiu este furnizată de membrana ATPază (Na +, K +) - ATPază, care necesită activarea ionilor Na +, a ionilor K + și, de asemenea, a ionilor Mg2 +.
Ionii penetrează membrana prin canale care sunt capabile să facă distincția între speciile de transportoare de încărcare. Permeabilitatea relativă a canalelor pentru diferite tipuri de ioni (selectivitatea canalelor) se reflectă în potențialul de echilibru. Un potențial de echilibru este potențialul la care curentul total care trece prin canal este zero. Acest potențial este o funcție a gradientilor concentrațiilor de ioni pentru care membrana este permeabilă.
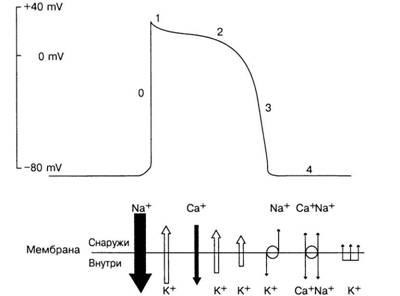
Fig. 6. Potențial de acțiune
(. Figura 6) În cazul în care membrana celulară pentru a atașa stimul electric de rezistență suficientă pentru a schimba PCB la nivelul potențial de prag, există o depolarizare rapidă - o schimbare bruscă a încărcare în interiorul celulelor la un rezultat pozitiv (+20 la - 30 mV). Depolarizarea (faza "0") se datorează introducerii rapide a ionilor de Na + în celulă (curent de sodiu rapid). Modificările de mai sus în permeabilitate, care determină dezvoltarea fazei "0" a PD, apar datorită deschiderii și închiderii canalelor sau porilor de membrane speciale prin care ionii Na + trec ușor. Se crede că funcționarea "porții" reglează deschiderea și închiderea canalelor individuale, care pot exista în cel puțin trei conformații: "deschis", "închis" și "inactivat".
Unele mișcare fluxul de ioni de sodiu porți deschiderea rapidă a canalului atunci când membrana brusc depolarized sub acțiunea stimulului. Alte porți se mișcă mai încet în timpul depolarizării, iar funcția lor este să închidă canalul. Pentru a descrie membrana de conductivitate de Na +, termenii „dependente de timp (Figura 7). - lNa» și «voltage-- lNa» (care se realizează prin intermediul celulelor depolarizare atrială sistemului His- - infarct ventricular Purkinje).
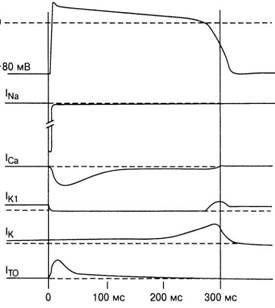
Fig. 7. Caracteristicile curenților ionici în timpul perioadei PD: In3 - intrarea Na + -TOK; 1ca - curenți de Ca2 +; Iki - curentul K + prin canalele K + care detectează; 1k - curentul K "prin canale lente, 1to - curent temporar din celulă în timpul fazei de repolarizare parțială
În cazul în care membrana este depolarized repaus brusc la nivelul unui potențial pozitiv, poarta de activare schimba rapid pozitia sa de a deschide canalele de sodiu, și apoi încet inaktivatsionnye porțile fiind închis. Cuvântul "lent" înseamnă aici că inactivarea durează câteva milisecunde, în timp ce activarea are loc în fracțiuni de o milisecundă. PD cu o rată atât de mare de creștere se răspândește rapid prin inimă și aceasta este caracteristică celulelor miocardului de lucru (celule de răspuns rapid). După depolarizare (faza "0") începe un proces lent de repolarizare - restaurarea PP originală. In celulele normale pentru curenții cardiaci de sodiu care intră responsabile pentru o creștere rapidă a PD, un al doilea curent de intrare, care este transferată în principal de ionii de calciu. Acest curent este denumit în mod obișnuit ca „intrare curent lent“ și curge prin canalele în funcție de caracteristicile de conductivitate în funcție de timp și de tensiune, numite „canale lente“. Celulele de lucru ale miocardului și a sistemului His- - prima fază Purkinje a repolarizării (. Figura 6, faza „1“) apare destul de rapid și se datorează eliberării de K + ioni și ionii de Cl intră în celulă.
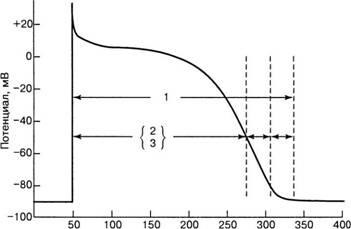
Timp, ms
Fig. 8. Perioade refractare: 1 - perioada de recuperare completă; 2 - perioadă refractară absolută;
3 - perioadă refractară eficientă; 4 - perioada relativă refractară;
5 - perioada excitabilității supranormale
Ulterior (faza „2“) asupra curenților de fundal ionii exterioare K + are loc intrarea Ca2 + ioni (și într-o măsură mai mică Na +) pentru canalele lente, în care viteza de depolarizare și repolarizare la timp este echilibrat și există un AP platou. Deoarece curentul total de la nivelul potențialului platoului transmembranar (m. E. algebrică suma tuturor componentelor curenților de intrare și de ieșire) devine, schimburi potențiale ale membranei mai rapid din ce în ce apar în direcția negativă și începe o etapă finală repolarizarea rapidă a PD. La capătul platoului canale lente încep să se închidă, și conductivitatea K ionilor + cresc in mod dramatic - accelerat repolarizarii ( „3“ faza) și revine la nivelul său inițial PP. După aceasta, diastolul începe (faza "4"). Potențialul de membrană a celulelor miocardice normale de lucru rămâne constantă la potențialul de repaus pe parcursul diastolă, în cazul în care aceste celule nu sunt incantati de pulsul de înmulțire, PP au menținut pe termen nelimitat.
În timpul depolarizării și în cea mai mare parte a repolarizării, până la nivelul potențialului de membrană de 60 mV, celulele de răspuns rapid (în principal miocardul de lucru al atriului și ventriculilor) sunt complet inexprimabile. Această condiție se numește perioada refractară absolută (ARP) - 0, 1, 2 faze PD (Figura 8). În timpul AP, orice stimul electric nu provoacă PD. După terminarea ARP, celula își restabilește excitabilitatea. Această perioadă se numește perioada relativă refractară (PPR). În timpul PIU, numai stimulul de creștere a rezistenței poate provoca PD. Viteza impulsului în timpul UIP este redusă.
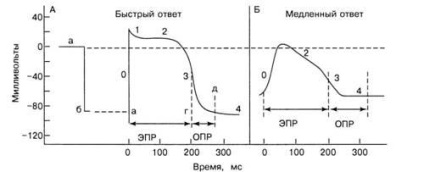
Fig. 9. Potențial de acțiune și perioade refractare ale celulelor cu răspuns rapid (A) și lent (B)
Perioada refractară eficientă (ERP) este intervalul minim dintre doi stimuli, când cel de-al doilea stimul nu provoacă PD. Perioada refractară funcțională (FFR) este intervalul minim între două impulsuri consecutive prin această sau o altă parte a miocardului.
Refractivitatea previne mișcarea circulară a undei de excitație prin miocard, protejând miocardul de re-excitație prea rapidă, ceea ce ar putea încălca funcția contractilă.
Activitatea electrică a celulelor nodului CS, AV și a celulelor miocardului de lucru este diferită (Figura 9). Celulele nodului CS și AV se numesc celule cu răspuns lent. PP-ul lor este - 60 mV. La această PP valoare canalelor de sodiu rapide sunt parțial închise (inactivat) și depolarizarea se produce în principal din cauza curentului de Ca2 + ioni și Na + pe canalele lente, astfel încât faza PD „0“ în celulele SU și nodul AV are un caracter blând, depolarizarea lin în repolarizare.
Celulele SU și AV sunt capabile de automatism, adică de generarea independentă de PD. Celulele CS sunt, de obicei, active și rareori în repaus, generând activitate electrică ciclic, depolarizată și hiperpolarizată spontan, astfel că atunci când le descriem, termenul "PP" nu este practic utilizat. Capacitatea țesutului de a se depolariza spontan se numește activitate stimulatoare a stimulatorului. Cei trei factori principali determină frecvența generării pulsului natural în SS: potențialul maxim în diastol, valoarea pragului potențialului și viteza și înclinația fazei de depolarizare.
Schimbările în oricare dintre cei trei factori conduc la o întrerupere a timpului necesar pentru faza "4". Aceasta poate cauza încălcarea vitezei de generare a impulsurilor. Nodul SU nu este singura parte a inimii care posedă
Această capacitate, cu toate acestea, el este excitat cu o frecvență ridicată, și, prin urmare, pacemaker dominantă a inimii în condiții normale. Activitatea stimulatorului cardiac în nodul AV este mai puțin pronunțată decât în SS. În alte stimulatoare cardiace ( „centre de automatism ordinul al doilea“), rata de depolarizare diastolică spontană, frecvența de descărcare este mai mică și, de asemenea, ele sunt numite stimulatoare cardiace ectopice (latente ascunse). relațiile ierarhicà între stimulatoare cardiace dominante si auxiliare, astfel încât ritmul cardiac este determinat de cea mai mare PD generarea de frecventa de carte miocardice care suprimarea cu focare generatoare de impulsuri de nivel rare a impus ( „uzurpă“) inima ritm propriu și este, astfel, stimulator cardiac ( centru de automatism). automatismul funcției depinde de influențele neurohumorale care determină frecvența generării spontane de impulsuri în funcție de nevoile organismului. SU generează în mod normal impulsuri electrice cu o frecventa de 60-80 1 min, compus AB - 40-60 1 min, Picioarele lui bundle - 15-40 1 min, fibrele Purkinje - cu 15-30 1 min.
PD, care a avut loc într-o parte a inimii (în normă - în SS), se răspândește în celulele vecine.
Principalii parametri electrofiziologici care determină viteza de realizare sunt viteza și amplitudinea fazei "0" a PD. Viteza pulsului în miocardul de lucru -0,3-1 m / s, un sistem de bloc de ramură - Purkinje - până la 4 m / s, în țesuturile SU și A-B-noduri -0,02-0,1 m / s.