Informații generale despre valența siliciului
Siliciul se află în a treia perioadă a grupului IV din subgrupul principal (A) al tabelului periodic.
Siliciul este stabil doar într-o modificare de tip diamant (cub). Punctul de topire refractar este de 1415 ° C și are o duritate ridicată. Are o culoare gri închis și un aspect metalic. La temperatura camerei, siliciul este un semiconductor. Grafitul modificării siliciului este instabilă.
Valence de siliciu în compuși
Siliconul este cel de-al paisprezecelea element al mesei periodice. Universitatea Mendeleev. El se află în a treia perioadă din grupul IVA. Nucleul atomului de siliciu conține 14 protoni și 14 neutroni (numărul de masă este de 28). În atomul de siliciu există trei niveluri de energie, pe care sunt 14 electroni (Figura 1).
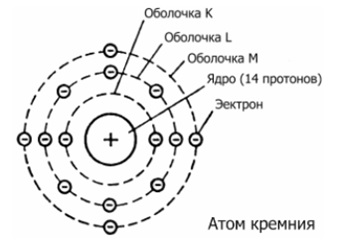
Fig. 1. Structura atomului de siliciu.
Formula electronică a atomului de siliciu în starea solului are următoarea formă:
Și diagrama energiei (construită doar pentru electronii de nivelul energiei externe, care se numește valență într-un alt mod):
Prezența a doi electroni neparticipați indică faptul că siliciul este capabil să manifeste valența II (Si II O).
Deoarece al treilea strat, în plus față de energie 3s-subnivelul are de asemenea 3p-subnivel, caracterizat printr-un atom de siliciu stare excitată: 3s-electron pereche subnivel și aburii unul dintre ei ocupă vacant orbitale 3p-subnivel.
Având patru electroni nepereche indică faptul că siliciul caracterizat de asemenea, valența IV (cel mai frecvent) (Si IV O2. H2 Si IV O3. Si IV H4. Ca2 Si IV. Si IV F4 și colab.).
Exemple de rezolvare a problemelor
Se calculează masa de siliciu care poate reacționa cu o soluție caldă alcalină de 200 ml (NaOH 35%, densitate 1,38 g / ml). Determinați cantitatea de hidrogen eliberată ca urmare a acestei reacții.
Se scrie ecuația reacției:
Să găsim masa soluției de hidroxid de sodiu și, de asemenea, masa substanței dizolvate a hidroxidului de sodiu din acesta:
msolution = Vsolution × ρ;
msolu = 200 × 1,38 = 276 g.
ω = msolute / msolu × 100%;
msolute = ω / 100% × msolution;
msolute (NaOH) = ω (NaOH) / 100% x soluție;
(NaOH) = 35/100% x 276 = 96,6 g.
Se calculează cantitatea de mol de hidroxid de sodiu (masa molară este de 40 g / mol):
n (NaOH) = m (NaOH) / M (NaOH);
n (NaOH) = 96,6 / 40 = 2,415 mol.
Conform ecuației de reacție n (NaOH): n (H2) = 1: 1. Prin urmare,
n (NaOH) = n (H2) = 2,415 mol.
Apoi, volumul de hidrogen eliberat va fi:
V (H2) = 2,415 × 22,4 = 56 l.
Conform ecuației de reacție n (NaOH): n (Si) = 2: 1. Prin urmare, cantitatea de material de siliciu va fi:
n (Si) = 2 x n (NaOH) = 2 x 2,415 = 4,83 mol.
Apoi masa de siliciu reacționată va fi egală (masa molară - 28 g / mol):
m (Si) = n (Si) x M (Si);
m (Si) = 4,83 x 28 = 135,24 g