Tranziții de fază ale lipidelor
Într-un mediu apos, structurile lipidice se comportă adesea ca cristale lichide - au anizotropie și unele semne de comandă. Acest lucru se datorează faptului că ele pot forma straturi duble într-un mediu apos ca molecule amfifilice (amfipatice) dublu-catenare. Capurile polare sunt astfel transformate într-un mediu apos, iar cozile nepolare creează un mediu hidrofob.
Bilaterul are proprietățile mezomorfismului litoral (dependența de stare de hidratare) și mezomorfismul termotrop (dependența de temperatură de stare). Aceste proprietăți sunt legate unele de altele - temperatura tranziției de fază depinde de gradul de hidratare, precum și de pH, încărcare electrică și compoziția ionică a soluției.
Când se atinge temperatura critică, o tranziție de fază de la starea cristalului lichid la gel și viceversa are loc în bistratul lipidic. Într-o bistratificată complet omogenă (constând dintr-un singur tip de molecule lipidice), tranzițiile de fază sunt cooperative. Adică, în intervalul de temperatură îngust, acestea sunt acoperite de întreaga barieră.
În momentul tranziției de fază, mobilitatea capetelor polare și cozile hidrofobe crește, geometria schimbărilor bistratificate - crește suprafața și crește volumul hidrofob al membranei.
Tranzițiile de fază în membrană au tendința de a coopera, adică generalizarea cu ajutorul așa-numitelor semnale sensibile la conformație.
Proporția de proteine din masa totală a membranei poate varia în limite foarte largi - de la 18% în mielină până la 75% în membrana mitocondrială.
Prin localizarea în membrană, proteinele pot fi împărțite în: integral și periferic.
Proteinele integrate sunt, de regulă, hidrofobe și pot fi ușor încorporate în bilayerul lipidic.
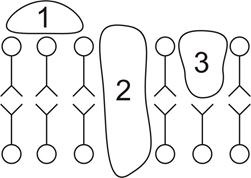
Fig. 9. Clasificarea proteinelor la locul lor în membrană. 1 periferic. 2 integrate; 3-poluintegralnye.
Interacțiunea unei astfel de proteine cu membrana are loc în mai multe etape. Mai întâi, proteina adsorbită pe suprafața stratului dublu, își schimbă conformația. stabilirea unui contact hidrofob cu membrana. Apoi, proteina este introdusă în bistrat. Adâncimea de implantare depinde de intensitatea interacțiunii hidrofobe și de raportul dintre regiunile hidrofobe și hidrofile pe suprafața globulei proteice. Regiunile hidrofile ale proteinei interacționează cu straturile de membrană de pe una sau ambele părți ale membranei. Fixarea globulei de proteine în membrană are loc datorită interacțiunilor electrostatice și hidrofobe. Partea carbohidraților a moleculelor de proteine (dacă există) se extinde spre exterior. Proteinele integrate datorate legăturii strânse cu bistratificatul au un efect semnificativ asupra lui: modificările conformaționale ale proteinei conduc la o modificare a stării lipidelor, așa-numita deformare a bistratificatului.
Proteinele periferice au o adâncime mai mică de penetrare în bilayerul lipidic și, prin urmare, interacționează mai slab cu lipidele membranei, făcându-le un impact mult mai mic decât cele integrale.
Prin natura interacțiunii cu membrana, proteinele sunt împărțite în monotopic, bitopic, poliopic:
proteinele monotopice interacționează cu suprafața membranei (mono - unul dintre straturile de lipide);
bitopic permează membrana prin (bi - două straturi de lipide);
politopic pierde membrana de mai multe ori (interacțiunea poli-multiplă cu lipide).
Este clar că prima se referă la proteine periferice, iar cea de-a doua și cea de-a treia la proteinele integrale.
Proteinele din membrană pot fi, de asemenea, clasificate în funcție de funcția lor. În acest sens, proteinele structurale sunt izolate:
Un grup special este proteinele citoscheletului celulei. Strict vorbind, aceste proteine nu sunt componente ale membranei, aderandu-se la aceasta din partea citoplasmatica. Proteinele citoscheletului sunt incluse în toate componentele sale: myofilamentele conțin molecule de proteină actinică; microtubulul conține tubulină proteică, filamentele intermediare conțin, de asemenea, un complex proteic mai polimorf. Citozelul nu numai că asigură elasticitatea membranei, dar rezistă modificărilor volumului celular, dar, aparent, participă la diferite mecanisme de reglare intra- și extracelulară.