4. Spin quantum number. denotată (ms), nu este asociată cu caracteristica orbitalilor atomici, ci caracterizează condiționat rotația electronului în jurul axei sale; poate lua doar două valori: +1/2 și -1/2, care diferă una de cealaltă, precum și valorile celorlalte numere cuantice, de una.
Primele trei numere cuantice caracterizează orbita pe care se află electronul dat; al patrulea număr cuantic caracterizează comportamentul unui electron într-o anumită orbitală.
Caracteristicile generale ale electronului într-un atom mulți electroni este guvernat de un principiu care a fost formulată în 1925 de Wolfgang Pauli (1900-1958).
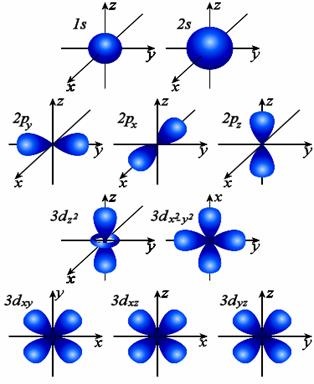
Fig. 1. Forme și orientare în spațiul nori de electroni ai orbitalilor 1s, 2s, 2p și 3d
într-un atom nu pot exista doi electroni cu aceleași numere cuantice.
Aceasta înseamnă că nu pot exista mai mult de doi electroni pe o orbită caracterizată prin trei numere cuantice. Doi electroni, localizați pe aceeași orbitală, diferă unul de altul de valorile numărului de spin cuantic, adică se caracterizează prin rotiri opuse sau antiparale, numite perechi. O astfel de pereche de electroni, localizată pe aceeași orbitală, este reprezentată schematic prin săgeți direcționate opus, în timp ce o singură pereche, adică Electronul nepereche este reprezentat de o săgeată pe o orbită.
Electronul din atom tinde să-și ia locul cu cea mai mică rezervă de energie.
Avantajul energetic al unui loc într-un atom poate fi determinat de regula Klechkovsky:
avantaj energetic al spațiului determinat de cea mai mica suma numerelor principale și laterale cuantice (n + l), în cazul în care această sumă este aceeași, electronii sunt umplute cu mai puține subnivele n.
Plecând de la regula Klechkovsky, electronii vor umple subsolurile în următoarea secvență:
1s 2 2s 2 2p 6 3s 2 3p 6 2 4s 3d 4p 10 6 2 4d 10 5s 5p 6s 2 4f 6 5d 14 10 6 6p 7s 2 5f 6d 14 10 14 6f 7p 6
Exemplul 12. Notați formula electronică a atomului 18 Ar. Determinați numărul de nivele, sublevels, electroni de valență.
Notați: formula electronică a atomului 18 Ar
Principiul 1.Iskhodya Aufbau de electroni vor umple subnivele în următoarea succesiune: 1s (atomii e formula Ar) 2s 2 2 2 2p 6 3s 3p 6.
2. Numărul de niveluri în atomul Ar-3.
3. Sublevelle atomului Ar (s, p).
numărul de electroni 18 Ar 1s 2 2s 2 2p 6 3s 2 3p 6. Electronii Valence: 3s 2 3p 6.
Răspuns: Formula electronică 18 Ar 1s 2 2s 2 2p 6 3s 2 3p 6. numărul de niveluri în atomul Ar-3; s-, p-sublevels, electroni de valență: 3s 2 3p 6.
Umplerea orbitalilor cu electroni într-un subsol apare conform regulilor lui Gund.
Prima regulă a lui Gund. În acest subsol, electronii tind să umple stările energetice astfel încât rotația totală să fie maximă.
A doua regulă a lui Gund. Starea minimă este starea cu suma maximă a numerelor magnetice cuantice.
O legătură chimică este înțeleasă ca fiind diferitele tipuri de interacțiuni care determină existența stabilă a compușilor doi și policatomi: molecule, ioni, substanțe cristaline și alte substanțe.
O legătură chimică formată de socializarea unei perechi de electroni de doi atomi se numește o legătură covalentă.
Pentru a descrie legăturile chimice, metodele simplificate sub-empirice, metoda de legare a valenței (MBC) și metoda orbitalelor moleculare (MMO), sunt cele mai utilizate pe scară largă în prezent. Aceste metode se bazează pe conceptele mecanicii cuantice.
MBC presupune. că interacțiunea dintre atomi se realizează numai datorită electronilor nepartiți.
Principalele prevederi ale AIM:
a) legătura chimică dintre doi atomi apare ca urmare a suprapunerii AO cu formarea de perechi de electroni;
b) atomii care intră într-un schimb de legături chimice între ei electroni, care formează perechi de legare. Energia schimbului de electroni între atomi (energia atragerii atomilor) face ca principala contribuție la energia legăturii chimice. O contribuție suplimentară la energia de legare este asigurată de forțele de interacțiune Coulomb ale particulelor;
c) în conformitate cu principiul Pauli, o legătură chimică se formează numai atunci când electronii interacționează cu rotirile antiparalel;
d) caracteristicile legăturii chimice (energie, lungime, polaritate etc.) sunt determinate de tipul de AO suprapus.
Se pot forma perechi electronice generale:
a) prin mecanismul de schimb;
b) asupra mecanismului donator-acceptor.
Mecanismul de schimb - o pereche electronică comună este formată din electronii neparticipați ai ambilor atomi care interacționează.
Astfel, formarea moleculelor de H2. Cl2 poate fi reprezentat după cum urmează:
Schema 1. Circuite electronice ale moleculelor H2. Cl2
Atunci când se formează perechi de electroni, numărul de electroni de pe stratul exterior crește pentru ambii atomi.
Pentru o înregistrare simplificată și mai vizuală, se utilizează circuite de valență. în care fiecare pereche electronică comună este notată cu o linie.
Dacă în formarea unei molecule se folosește numai mecanismul de schimb de formare a legăturii, atunci schema de valență coincide în formă cu formula structurală a compusului.
Mecanismul donator-acceptor - legătura se formează datorită perechii de electroni a unuia dintre atomi și orbitalului liber celuilalt.
Astfel, valența totală a elementului este egală cu numărul de electroni neparticipați (mecanismul de schimb) și numărul de legături formate de mecanismul donor-acceptor.
În funcție de natura suprapunerii norii electronici, # 963; - (sigma -), π - (pi-) și # 948; - conexiunile (delta) (figura 2).
Legătura Sigma-bond (# 963;). formată prin suprapunerea AO de-a lungul unei linii care leagă nucleele atomilor care interacționează (figura 3).
# 963; -bond pot apărea atunci când se suprapun s orbitali, Orbitali și p, S- p Orbitali, Orbitali d, d - și s Orbitali, Orbitali d- și p și Orbitali f reciproc, și atunci când se suprapun orbitale hibride.
Se numește conexiunea formată de suprapunerea d-orbitalelor cu toate cele patru lobi # 948; - conexiune (Figura 5).
Figura 5. Direcții de suprapunere a d-orbitalilor atomici,
Proprietăți de legătură covalentă
1. Directivitatea legăturii covalente. Direcția de comunicare este determinată de tipul de hibridizare al SAI. În formarea legăturilor covalente, se presupune că nu doar "orbele atomice" pure (AO) participă, ci și "amestecurile" așa-numitele AO hibride. În hibridizare, forma originală și energia orbitalilor (norii de electroni) se schimbă reciproc și se formează orbite (nori) de o nouă formă identică și o energie egală. Numărul orbitalilor hibrizi (q) este egal cu numărul de orbitale inițiale. Structura moleculelor de tip AB, în funcție de tipul de hibridizare, este prezentată în Tabelul. 6.
Dacă un s- și un p-orbitale (sp-hibridizare) participă la hibridizare, atunci se formează două sp orbitale echivalente; De la o s- și două p-orbitale (sp 2-hibridizare), se formează trei sp2-orbitale și așa mai departe.
nor Hybrid corespunzător unui anumit tip de hibridizare, sunt aranjate într-un atom, astfel încât interacțiunea dintre electroni este redus la minim, adică cât mai departe posibil. Prin urmare, norii de electroni sp-hibridizare sunt orientați în direcții opuse. Când sp 2 -hybridization - în direcții situată într-un plan și care constituie împreună un unghi de 120 ° (adică în direcțiile spre vârfurile triunghiului echilateral) la sp 3 -hybridization - la vârfurile unui tetraedru (unghiul dintre aceste direcții este 109 ° 28 „), cu sp 3 hibridizarea d 2 - la vârfurile unui octaedru (adică de-a lungul direcții reciproc perpendiculare).
Orientarea cantitativă este exprimată sub formă de unghiuri de valență între direcțiile legăturii chimice în molecule și solide.
2. Saturația legăturii covalente este cauzată de restrângerea numărului de electroni pe carcasele exterioare care pot participa la formarea unei legături covalente. De exemplu, hidrogenul are un electron, deci o legătură. Prin urmare, H2 este posibil. dar nu H3.
3. Polaritatea legăturii covalente. Dacă legătura covalentă este formată de atomi identici, de exemplu H-H, O = O, Cl-Cl, N = N, atunci electronii partajați cu electronii sunt distribuiți uniform între ele.
O astfel de conexiune se numește o legătură covalentă nepolară. Dacă unul dintre atomi atrage electronii mai puternic, atunci perechea de electroni se îndreaptă spre acest atom. În acest caz, apare o legătură covalentă polară.
Datorită deplasării perechii de electroni la unul dintre nuclee, densitatea încărcării negative într-un atom dat crește și, în consecință, atomul primește o sarcină, numită încărcarea efectivă a atomului # 948; -. Al doilea atom crește densitatea încărcăturii pozitive # 948; +.
Schimbarea electronilor și polaritatea legăturii sunt cu atât mai mari, cu atât mai mare este diferența dintre electronegativitatea elementelor interacționante.