Te-ai întrebat vreodată ce forțe țin o moleculă de materie de la decădere în atomi? Astăzi se știe că aceste forțe sunt numite forțe chimice și sunt de natură electromagnetică. În general, legătura chimică poate fi explicată ca rezultat al colectivizării electronilor de valență externă ai atomilor de legătură. La anumite distanțe dintre nuclee colectivizate, de exemplu, electronii dintr-o moleculă de hidrogen. trecând printre nuclei, reduc repulsia acestuia din urmă. La distanțe mari, colectivizarea nu apare.
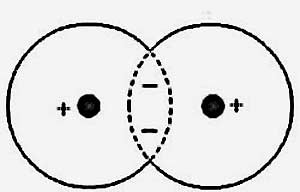
Luați în considerare cea mai simplă moleculă de hidrogen H2. Electronii dintr-o moleculă de hidrogen se comportă ca și cum fiecare electron a petrecut o parte a timpului lângă un nucleu și o parte aproape de cealaltă. Iată de ce forțele care apar în acest caz sunt adesea numite forțe de schimb. Adică, electronii din molecula de hidrogen aparțin deja la două nuclee simultan. În același timp, individualitatea atomilor de hidrogen sa dizolvat în timpul fuziunii lor într-un sistem nou - o moleculă de hidrogen, în care există acum două protoni și doi electroni.
Sare de masă. de exemplu, 8 electroni de valență sunt obișnuiți. Una dintre ele este luată din sodiu și 7 din clor. Deoarece încărcarea reziduală a clorului este mai mare decât cea a sodiului, toți electronii colectivizați sunt puternic deplasați spre nucleul clorului, iar socializarea pare mai devreme ca captarea unui electron cu un atom "mai puternic" în cel mai "slab". Aproximativ, acesta din urmă devine un ion pozitiv, iar cel dintâi devine negativ, iar legătura chimică se reduce la atracția unor încărcături asemănătoare.
Atunci ce determină valența atomului? Pentru a explica acest lucru, ia în considerare ce se va întâmpla dacă, de exemplu, shooter-ul împușcă o pușcă dintr-o pușcă într-o țintă care se poate roti liber în jurul unui unghi introdus în "top zece". Odată ajuns în țintă, gloanțele îl vor face să se rotească: momentul rotativ al glonțului este distribuit între glonț și țintă.
Acum permiteți țintă să fie tras cu electroni sau alte particule elementare. Dacă toți sunt "răsuciți" într-o direcție, atunci, absorbiți-i, ținta se va întoarce. Rotația va fi mai intensă, cu atât mai mult va fi rotirea particulelor. Un electron, de exemplu, poate fi "răsucite" numai în două moduri: "rotirea" unui electron formează fie un șurub drept, fie unul stâng, cu direcția mișcării sale. De aceea, dacă rotația unui electron este îndreptată într-un anumit mod, atunci rotația celuilalt este fie paralelă cu el, fie antiparallel.
Atunci când se formează molecule, totul depinde de direcția rotirilor. Astfel, o legătură chimică într-o moleculă de hidrogen apare numai atunci când electronii colectivizați dintr-o moleculă de hidrogen au rotiri îndreptate opus. Toți, deoarece pentru rotirile antiparalel electronii petrec un timp relativ lung între nuclee, astfel încât densitatea medie a încărcăturii negative este suficientă pentru a echilibra repulsia nucleelor. Pentru rotirile paralele, această densitate este mică, iar nucleele sunt respinse!
Dar de ce nu trei electroni conectează trei nuclee simultan? Se pare că mecanica cuantică impune o interdicție specială asupra mișcării electronilor. Se numește principiul Pauli. Doi electroni, conform acestui principiu, nu pot fi în aceeași stare. Electronii dintr-o moleculă de hidrogen pot diferi numai în orientarea rotirilor. Și numai două orientări sunt posibile. Și al treilea electron aici este inutil.