9. Elemente nemetalice și compușii lor. Nemetale
Acidul sulfat H2SO4 este o substanță cu structură moleculară. Atomul de sulf formează șase legături covalente și dobândește o stare de oxidare de +6:
Acidul sulfat anhidru este un lichid uleios greu, fără culoare și miros, un non-ulei. Foarte higroscopic, amestecat cu apă în orice proporție. Dizolvarea acidului în apă este însoțită de eliberarea unei cantități mari de căldură, astfel încât pentru diluarea sa, acidul este turnat cu grijă în apă, amestecând în mod necesar soluția!
O soluție de acid cu o fracție de masă de H2SO4 mai mică de 70% se numește diluată și, dacă fracțiunea de masă depășește 70%, este concentrată. Cel mai adesea, în laboratoare se utilizează o soluție concentrată cu o fracție de masă de H2SO4 de 96% (densitate - 1,84 g / ml).
Extracția acidului sulfuric
Cea mai importantă metodă industrială de obținere a acidului sulfuric este metoda de contact. Procesul de obținere are loc în trei etape:
1. Prepararea oxidului de sulf (IV) prin arderea de pirită:
2. Oxidarea oxidului sulfurat (AND V) la oxidul sulfuric (V I). Reacția este reversibilă, exotermă și catalitică. Catalizatorii de reacție sunt platina sau oxidul de vanadiu (V) V205. Temperatura optimă de reacție este de 400-470 ° C:
3. Dizolvarea oxidului de sulf (V I) în acid sulfat:
Apoi se adaugă apă la oleum, obținându-se acidul cu concentrația necesară:
Proprietăți chimice ale acidului sulfuric
Acidul sulfat este un acid puternic dibazic. Se caracterizează prin reactivitate ridicată. Acidul sulfat diluat - un electrolit puternic, prezintă proprietățile tipice ale acizilor.
1. Cum acidul dibazic disociază treptat cu formarea ionilor de sulfat de sulf și a ionilor de sulfat:
Acidul sulfat este puternic, disocierea sa în prima etapă are loc aproape complet.
2. Acidul sulfat diluat reacționează cu metalele care sunt plasate în rândul virgin la stânga hidrogenului, cu oxizi de bază și amfoterici, cu baze care formează săruri acide și medii, cu câteva săruri:

Interacțiunea dintre ionii Ba2 + și SO4-2 are ca rezultat formarea unui precipitat alb de BaS04 care este insolubil în apă și acizi.
2. Acidul sulfat concentrat ca acid puternic și neretențios înlocuiește acizii volatili din sărurile lor:
3. Când este încălzit peste 200 ° C, acidul sulfat anhidru este descompus parțial:
4. Acidul sulfat concentrat este capabil să îndepărteze apa din substanțe organice, în timp ce le arde - se descompune la carbon:
5. Proprietăți oxidante ale acidului sulfuric.
Acidul sulfat diluat prezintă proprietăți slabe de oxidare datorate ionilor de H +. care se observă în reacțiile cu metalele:
Acidul sulfat concentrat prezintă proprietăți puternice de oxidare când este încălzit. Acest lucru se datorează faptului că sulful în acid are o stare de oxidare mai mare - +6. Acidul sulfat concentrat oxiguează acele metale care sunt plasate în rândul virgin la stânga hidrogenului și cele care sunt plasate în partea dreaptă a acestuia; În acest caz, Sulful poate fi redus la hidrogen sulfurat, sulf sau oxid de sulf (IV):
Gradul de oxidare, care dobândește recuperarea produselor de sulf depinde de concentrația de acid sulfuric și natura (agent de reducere) alt reactant: că un agent reducător mai puternic care reacționează cu acidul, cu atât mai adânc procesul de restaurare:
a) Metalele puțin active (Cu, Hg, Ag) reduc acidul sulfat concentrat la oxidul de sulf (IV):
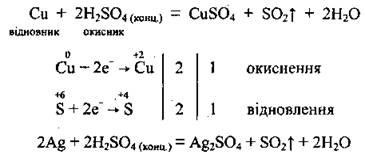
b) metalele active (alcaline și alcalino-pământoase) restabilește acidul sulfat concentrat la hidrogen sulfurat:
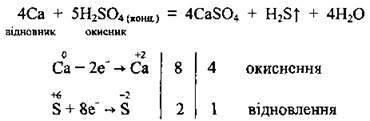
.. C) Activitatea medie a metalelor (Zn Al Mg), în funcție de concentrația de acid, se poate recupera simultan acid concentrat sulfat pentru diferitele produse de reducere - sulf, dioxid de sulf și hidrogen sulfurat:
d) acidul sulfat concentrat nu reacționează cu fier, aluminiu, crom în condiții standard. Acest lucru se datorează faptului că pe suprafața metalului se formează un film subțire de oxid, care este inert relativ la acid în aceste condiții. Un astfel de proces se numește pasivatsiyu 1. Când este încălzit, aceste metale se dizolvă în acizi, formând săruri cu un grad mai mare de oxidare a metalului:
Când se încălzește cu acid sulfat concentrat, practic toate metalele, cu excepția aurului și platinei, reacționează. Acidul sulfat concentrat oxidează și nemetalele:
Acidul sulfat concentrat oxidează ionii de bromură și iodură la halogeni liberi, dar nu poate oxida ionii de clor până la C12. care face posibilă extragerea HC1 din săruri cu participarea sa:
Săruri de acid sulfuric
Ca acid dibazic, acidul sulfat formează două serii de săruri: mediu, numiți sulfați și sulfat acid herogenic. Printre sulfații se numără sărurile conținând apă cristalină; unele dintre ele sunt numite vitriol.
Proprietati chimice ale sulfatilor
1. Sulfații prezintă proprietăți comune ale sărurilor: interacțiunea cu metalele, anumiți acizi și săruri:
2. În timpul încălzirii:
a) sulfații metalelor active (alcalini și alții alcalini) nu se descompun chiar la 1000 ° C;
b) sulfații elementelor metalice cu activitate medie se descompun în oxid și oxid de sulf (V):
c) sulfații de Cu. Fe. Al se descompune chiar și cu încălzire nesemnificativă:
d) sulfații unor elemente metalice se descompun pentru a forma un metal, oxid de sulf (IV) și oxigen:
Utilizarea acidului sulfuric și a sulfatului
Acidul sulfat este utilizat pentru a extrage explozivi, cum ar fi un desicant de gaz, în timpul procesării minereurilor; producția de îngrășăminte de acid ortofosfat și fosfor, medicamente și o serie de substanțe organice (fibre, materiale plastice, vopsele); pentru curățarea produselor petroliere, a suprafețelor metalice ale produselor înainte de aplicarea unui înveliș de protecție; ca electrolit în baterii.
Sulfatul de magneziu heptahidrat MgS04 · 7H2O și sulfatul de sodiu Decaedrat Na2SO4 · 10H2O sunt utilizate în medicină ca purgativă.
Galuns (săruri duble cu formula generală Me + Me 3+ (SO 4) 2 · 12H 2 O) sunt utilizate în medicină, precum și în timpul procesului de vopsire a țesăturilor și tăbăcire a pielii.
Ghipsul și sulfatul de calciu sunt utilizate în medicină și construcții.
Sulfatul de potasiu și sulfatul de amoniu sunt utilizate ca îngrășăminte.
Sulfatul de bariu este utilizat în producția de hârtie, cauciuc, vopsea minerală albă, precum și în medicina pentru fluoroscopia tubului digestiv.
Cuprul și fierul vitriol sunt folosite în agricultură pentru combaterea dăunătorilor și a bolilor plantelor; în producția de vopsele, pentru impregnarea lemnului (pentru controlul dăunătorilor) și ca antiseptic.
Sulfatul de sodiu este uneori utilizat în locul altor săruri de sodiu în timpul producției de sticlă și sifon.
1 Deoarece fierul este pasivat cu acid sulfuric concentrat, acesta este transportat și depozitat în cisterne de fier.