Obiectiv: determinarea echivalentului unui metal folosind o metodă de evaluare.
Scurtă parte teoretică:
Elementele interacționează între ele în relații cantitative definite strict. Conform legii echivalente, atunci când moleculele sunt formate din elemente, ele sunt legate între ele prin mase proporționale cu masele echivalenților lor chimici.
Echivalent este o particulă condiționată a unei substanțe care într-o reacție acido-bazică este echivalentă cu un ion de hidrogen sau într-o reacție de oxidare-reducere la un electron.
Un echivalent chimic se numește și cantitatea sa, care se combină cu 1 mol de atomi de hidrogen sau înlocuiește același număr de atomi de hidrogen în reacțiile chimice.
Greutatea echivalentă sau masa molara ekvivalenta- un echivalent de masă de 1 mol de substanță [g / mol] .E = A / B, unde A - masa molară a elementului, B - element de valență stoichiometric.
Echivalentul unei substanțe complexe este cantitatea de substanță care interacționează fără reziduuri cu un echivalent de hidrogen sau cu un echivalent al oricărei alte substanțe.
Masa echivalentă de hidrogen este egală cu 1,008 g / mol, deoarece fiecare dintre atomii din moleculă interacționează cu un atom de hidrogen.
Masa echivalentă a acidului este egală cu masa molară a acestuia împărțită la bazicitatea acidului. Masa echivalentă a bazei este egală cu masa molară a acesteia împărțită la valența metalului care formează baza. Masa echivalentă a unei sări este egală cu masa molară, împărțită la produsul valenței metalului cu numărul de atomi din moleculă.
Echivalentul unui element poate fi găsit chimic - prin determinarea cantității de hidrogen (hidrogen) care trebuie adăugat (înlocuit) sau a oxigenului sau a oricărui alt element al cărui echivalent este cunoscut. În plus, echivalente și pot fi determinate prin mijloace electrochimice pe baza legii lui Faraday, potrivit căreia în timpul trecerii printr-o energie electrică 96484 kD evidențiată soluție de electrolit 1 substanță echivalentă.
Sarcina acestei lucrări este de a determina masa echivalentă de magneziu în conformitate cu legea echivalenților:
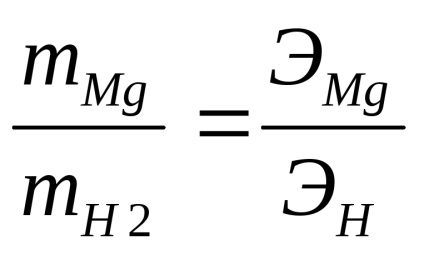
Este permisă presupunerea că în condițiile experimentale se aplică ecuația de stare a gazului ideal (ecuația lui Mendeleev-Clapeyron)
P este presiunea gazului,
m este masa substanței,
M este masa molară,
T este temperatura absolută,
R = 8,315 J / K · mol este constanta gazului universal.