Sistemul termodinamic este un sistem fizic macroscopic care este alocat (într-adevăr sau mental) pentru a studia. constând dintr-un număr mare de particule și nu necesită pentru descrierea sa atracția caracteristicilor microscopice ale particulelor individuale [1]. "O parte din univers, pe care o alocăm pentru cercetare" [2]. Unitatea de numărul de particule dintr-un sistem termodinamic serveste de obicei ca numărul Avogadro [3] (aproximativ 6 · 23 octombrie particule per mol de substanță) dă o idee valorilor ordinului respectiv. Limitele naturii particulelor materiale care formează sistemul termodinamic nu sunt suprapuse: ele pot fi atomi. moleculă. electroni. ioni. fotoni, etc. [4] [5]. Orice obiect vizibil cu ochiul liber sau cu instrumente optice (microscoape telescoape, etc ....) Poate fi atribuită unui sistem termodinamic, „Termodinamica se ocupă cu studiul sistemelor macroscopice, dimensiuni spațiale și existența lungime suficientă pentru a permite procesele normale de măsurare“ [4 ]. Condițional, sistemele macroscopice includ obiecte cu dimensiuni de la 10 -7 m (100 nm) la 10 12 m [6]. Natura condiționată a limitei inferioare este legată, printre altele, de faptul că dimensiunea unui obiect nu este importantă pentru termodinamică, ci pentru numărul de particule care îl formează. Un cub de gaz perfect cu o margine de 100 nm in conditii normale contine aproximativ 27.000 de particule (vezi Loschmidt Constant).
Orice parte a sistemului termodinamic se numește subsistem.
Fiecare sistem termodinamic are limite. reale sau condiționate, care o separă de mediul înconjurător [9]. Uneori, în loc de mediu, vorbesc despre un termostat [4]. adică, un mediu cu o astfel de capacitate mare de căldură. că temperatura sa în timpul schimbului de căldură cu sistemul studiat nu se modifică [10] [11] [12]. În mod implicit, se presupune că mediul este suficient de mare și, prin urmare, parametrii săi nu depind de procesele care apar în sistemul în cauză. În plus, se înțelege de obicei că mediul este într-o stare de echilibru termodinamic, iar caracteristicile sale sunt independente de coordonatele timpului și spațiului.
Este important ca compoziția sistemului termodinamic să includă toate particulele care sunt disponibile în zona spațiului alocat studiului. Faptul că, în termodinamica, uneori, același volum este considerat ocupat simultan de două sau mai multe cvasi-independent (slab care interacționează unele cu altele) subsisteme particule parțiale de natură diferită (de exemplu, un amestec gazos este caracterizat prin presiunile parțiale ale gazelor sale constitutive, [13] un cristal de și fononi emit subsistemul Magnon ;. un sistem de spini nucleari caracterizate de temperatură proprie parțială paramagnetic de spin [14] capabile să preia valori negative în Kelvin [15] [16] [17]). Această tehnică formală ne permite să introducem caracteristici parțiale pentru subsistemul luat în considerare. nu neapărat direct legate de sistemul fizic în ansamblul său (a se vedea, de exemplu, temperatura absolută negativă).
Clasificarea sistemelor termodinamice [ ]
Prin natura interacțiunii cu mediul, se disting sistemele [9]:
- izolat. nu schimbul cu mediul extern, nici energia, nici materia;
- adiabatic izolat. nu schimbul de substanțe de mediu, ci permiterea schimbului de energie sub formă de muncă [18];
- închis. schimbul de energie cu mediul extern, dar nu schimbul de substanțe;
- deschis. schimbul cu mediul extern și cu energia și materia;
- parțial deschise. schimbarea cu mediul extern și energia și materia, dar în care nu participă toate substanțele constitutive la schimbul de materiale (de exemplu, datorită prezenței partițiilor semipermeabile) [19].
În funcție de parametrii utilizați pentru descrierea termodinamică a sistemului, se disting stările: sisteme simple. simple sisteme deschise și sisteme complexe.
- Un sistem simplu (sistem simplu [20], sistem de deformare termică [21]) este un sistem de echilibru a cărui stare fizică este complet determinată de valorile a două variabile independente, funcțiile de stat ale unui corp simplu (x, y). de exemplu, prin valorile temperaturii și a volumului specific (t.v) sau a presiunii și a volumului specific (P.v). Exprimarea dependenței a trei caracteristici ale stării unui corp simplu (x, Y. Z). care sunt pereche independente, se numește ecuația de stare a acestui corp:
Organismele simple sunt izotrope corpului (isos- egale, tropos - direcția în ansamblu - caracteristicile ecuația de stare și proprietățile fizice ale corpului la toate punctele din toate direcțiile), inclusiv: gaze, vapori, lichide și multe solide, sunt termodinamic echilibru și nu este supus acțiunii tensiunii de suprafață, forțelor gravitaționale și electromagnetice și transformărilor chimice. Studiile unor corpuri simple în termodinamică sunt de interes maxim teoretic și practic.
Dacă substanțele care intră în sistem într-o anumită gamă de condiții (temperatura de presiune) nu interacționează chimic între ele, atunci sistemul este numit fizic. Dacă substanțele sistemului reacționează una cu alta, atunci vorbește despre un sistem chimic [24] [25] [26].
Izolarea reală a sistemului termodinamic din mediul înconjurător se realizează prin pereți (interfețe pereților despărțitori) [27]. mobile și fixe, permeabile și impermeabile la substanță (există, de asemenea, partiții semi-permeabile). Nava Dewar servește ca un bun exemplu de coajă adiabatică. Partiția, care nu interferează cu schimbul de energie, se numește diathermic.
Sistemul termodinamic se numește omogen. dacă proprietățile sale se schimbă continuu de la punct la punct [28]. Un sistem omogen cu aceleași proprietăți în orice punct se numește omogen [28]. Exemple de sisteme omogene sunt soluțiile (gaz, lichid și solid). Faza gazoasă într-o mare măsură de-a lungul gradientului câmpului gravitațional (de exemplu, atmosfera terestră într-o zi neclară și fără vânt) este un exemplu de fază omogenă neomogenă (a se vedea Formula barometrică).
Sistemul termodinamic este numit eterogen. dacă constă din mai multe părți omogene cu proprietăți diferite. Pe suprafețele care separă părțile omogene ale sistemului eterogen, proprietățile sistemului se schimbă abrupt [29]. Adesea (dar nu întotdeauna) această suprafață este vizibilă.
Partea omogenă a sistemului eterogen este numită faza [29]. Fazele mai puțin stricte, dar mai clar sunt "părțile omogene ale sistemului, separate de celelalte părți prin interfețe vizibile" [8]. Un exemplu este sistemul "gheață-apă-umed". Un sistem omogen conține doar o singură fază; Sistemul eterogen constă în două sau mai multe etape [30]. Numărul de faze într-un sistem eterogen respectă regula fazei Gibbs. Aceeași substanță într-o stare agregată solidă poate avea mai multe faze (sulf romanic și monoclinic, staniu gri și alb, etc.) [29].
Figura prezintă una dintre opțiunile de clasificare a sistemelor termodinamice.
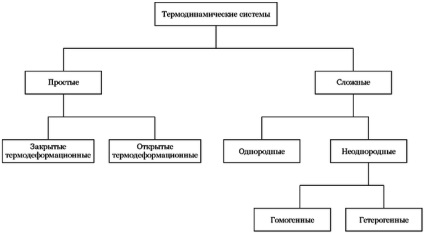
Una dintre opțiunile pentru clasificarea sistemelor termodinamice
Consultați de asemenea [ ]
Notă [ ]
Referințe [ ]
Un număr de note scurte nu sunt conținute în articol sau nu conduc la secțiunea "Literatură".