Faza termodinamică este o parte termodinamică omogenă a sistemului termodinamic, separată de alte faze prin interfețe, pe care anumite proprietăți ale sistemului se schimbă brusc.
Într-un sistem cu o singură componentă, diferite faze pot fi reprezentate de diferite stări agregate sau modificări polimorfe diferite ale materiei. Într-un sistem multicomponent, fazele pot avea compoziții și structuri diferite.
Gazul constă întotdeauna dintr-o fază, lichidul poate consta din mai multe faze lichide de compoziție diferită, dar două lichide diferite de aceeași compoziție nu pot coexista în echilibru. Starea solidă poate consta din mai multe faze, dintre care unele pot avea aceeași compoziție, dar structură diferită (modificări polimorfe, alotropie).
starea fizică a materiei rezerve, caracterizată prin anumite proprietăți de calitate - capacitatea sau incapacitatea de a menține volumul și forma, prezența sau absența pe distanțe lungi și ordine rază scurtă de acțiune, și altele.
Modificarea stării agregate este însoțită de o schimbare bruscă a energiei libere, a entropiei, a densității și a altor proprietăți fizice de bază. Se disting următoarele stări agregate: solid, lichid, gaz, plasmă.
Set de faze termodinamici sunt de obicei mult mai bogat set de stări agregate, adică aceeași stare a materiei poate fi în diferite faze termodinamice (gheață, de exemplu, are loc în cinci versiuni diferite - faze). Acesta este motivul pentru care problema descrisă în termeni de stări de agregare mai degrabă grosolănie, și nu se poate distinge între anumite situații fizice diferite.
În orice caz, în prezența unei divizări de faze, este implicată posibilitatea principală de trecere a unei substanțe de la o fază la alta.
Tranziția de fază (transformarea fazei) în termodinamică este tranziția materiei de la o fază termodinamică la alta când condițiile externe se schimbă.
Valoarea temperaturii, a presiunii sau a unei alte cantitati fizice la care tranzitiile de faza apar intr-un sistem cu o singura componenta se numeste punct de tranzitie.
Un exemplu de fază ne Trecerea poate fi schimbări în starea de agregare a substanței sau a tranzițiilor asociate cu modificări ale compoziției, build-SRI și proprietățile substanței (de exemplu, ne substanță Passing cristalină de modificări pe termen od la altul).
Deoarece împărțirea în faze termodinamice este o clasificare mai fină a stărilor decât separarea asupra stărilor agregate ale materiei, nu fiecare tranziție de fază este însoțită de o schimbare a stării agregate. Cu toate acestea, orice modificare a stării agregate este o tranziție de fază.
Există tranziții de fază a două genuri.
O tranziție de fază de prim ordin (de exemplu, topire, cristalizare etc.) este însoțită de absorbția sau eliberarea căldurii, denumită căldură de tranziție de fază.
Când prima tranziție de fază, pentru a schimba brusc cei mai importanți, parametrii primari extinse: volumul specific, cantitatea de energie internă stocată, concentrația componentelor, etc ...
Cele mai frecvente exemple de tranziții de fază de ordinul întâi sunt: topirea și cristalizarea, evaporarea și condensarea, sublimarea și desublimarea.
Tranzițiile de fază de primul tip sunt caracterizate printr-o temperatură constantă, schimbări în entropie și volum. O explicație pentru aceasta poate fi dată în felul următor.
O schimbare bruscă a proprietăților unei substanțe înseamnă un salt cu o schimbare a temperaturii și a presiunii. În realitate, prin afectarea sistemului, nu schimbăm aceste cantități, ci volumul și energia internă totală. Această schimbare se produce întotdeauna la o anumită rată finită, ceea ce înseamnă că, pentru a "acoperi" întreaga diferență în densitate sau energie internă specifică, avem nevoie de un timp finit. În acest timp, tranziția de fază nu are loc imediat în întregul volum al substanței, dar treptat. În acest caz, în cazul unei tranziții de fază de prim ordin, se eliberează (sau se retrage) o anumită cantitate de energie, numită căldura latentă a tranziției de fază. Pentru a se asigura că tranziția de fază nu se oprește, este necesar să se retragă (sau să se aprovizioneze) în mod continuu această căldură sau să se compenseze performanța lucrărilor în sistem.
De exemplu, atunci când topiți un corp, trebuie raportată o anumită cantitate de căldură care provoacă distrugerea rețelei de cristal. Căldura furnizată în timpul topirii nu duce la încălzirea corpului, ci la ruperea legăturilor interatomice, astfel încât topirea se face la o temperatură constantă. În astfel de tranziții, de la o stare cristalină mai ordonată la o stare lichidă mai puțin ordonată, gradul de tulburare crește și, din punctul de vedere al celei de-a doua lege a termodinamicii, acest proces este asociat cu o creștere a entropiei sistemului. Dacă tranziția are loc în direcția opusă (cristalizarea), sistemul eliberează căldură.
Tranzițiile de fază care nu sunt asociate cu absorbția sau eliberarea schimbărilor de căldură și de volum sunt numite tranziții de fază ale celui de-al doilea tip.
Aceste tranziții se caracterizează prin constanța volumului și a entropiei. În același timp, densitatea și energia internă nu se schimbă, astfel încât o astfel de tranziție de fază poate fi invizibilă pentru ochiul liber. Saltul este experimentat de derivații lor în ceea ce privește temperatura și presiunea: capacitatea de căldură, coeficientul de expansiune termică, diferite susceptibilități etc.
Un tratat general al tranzițiilor de fază de tipul al doilea a fost propus de omul de știință sovietic LD Landau (1908-1968). Conform acestei interpretări, tranzițiile de fază ale celui de-al doilea tip sunt asociate cu o schimbare a simetriei: deasupra punctului de tranziție, sistemul, de regulă, are o simetrie mai mare decât punctul de tranziție.
Cele mai frecvente exemple de tranziții de fază: sistemul de trecere prin punctul critic, paramagnetic tranziție sau feromagnetic-paramagnetic - antiferomagnet, metale tranziționale și aliaje în starea supraconductoare, tranziția de heliu lichid într-o stare superfluid, tranziția de material amorf, în stare sticloasă.
Fizica moderna investigheaza, de asemenea, sisteme care au tranzitii de faza de gradul trei sau mai mare. Recent, noțiunea de tranziție în faze cuantice a devenit larg răspândită. o tranziție de fază nu este guvernată de fluctuațiile termice clasice, ci de cele cuantice, care există chiar și la temperaturile absolute zero.
tranziții de fază în două genuri Division este oarecum arbitrară, deoarece există o fază de tranziție de primul tip cu salturi mici ale parametrului de ordine și încălziri mici de tranziție pentru fluctuații puternic dezvoltate. Acest lucru este cel mai tipic pentru tranzițiile dintre fazele cristaline lichide.
Topirea solidelor
Topirea și cristalizarea solidelor reprezintă un exemplu de tranziție de fază de prim ordin. proces de topire joacă un rol important în natură (topirea zăpezii și a gheții de pe suprafața Pământului, topirea mineralelor în interiorul său, etc.) și în stadiul tehnicii (producerea de metale și aliaje, turnare în matrițe și colab.).
Topirea este procesul de tranziție a unui corp de la o stare solidă cristalină la o stare lichidă.
Principalele caracteristici ale topirii substanțelor pure sunt punctul de topire (Tm) și căldura (căldura fuziunii Qpl), care este necesară pentru procesul de topire.
În procesul de topire, temperatura cristalului rămâne constantă. Această temperatură este numită și punctul de topire Tm. . Fiecare substanță are propriul punct de topire. Punctul de topire pentru o anumită substanță depinde de presiunea atmosferică. Cel mai mare punct de topire printre metalele pure este tungstenul (3410 ° C), cel mai mic -
mercur (-38,9 ° C).
temperatură constantă datorită faptului că topirea întregii caldura de intrare este în dezordine dispunerea spațială regulată a atomilor (molecule) în rețeaua cristalină. Pentru cele mai multe cristale (altele decât apa, și unele aliaje), topirea temperatura creste cu creșterea presiunii externe, deoarece atomii de distanțare unul față de celălalt, la o presiune mai mare necesită mișcări termice mai energetice, t. E. O temperatură mai mare.
Substanța topită are o rezervă mare de energie internă decât în stare solidă. Restul căldurii de topire sunt cheltuite pentru a efectua lucrări de schimbare a volumului corpului atunci când se topește. În timpul topirii, volumul majorității corpurilor cristaline crește (cu 3-6%) și scade odată cu solidificarea. Dar există substanțe în care volumul scade în timpul topirii și, atunci când se solidifică, crește. Acestea includ, de exemplu, apă și fontă, siliciu și altele. De aceea, gheața plutește pe suprafața apei, și fonta solidă - în propriul topit.
Topirea începe atunci când materialul cristalin ajunge la Tm. De la începutul topirii până la finalizarea sa, temperatura substanței rămâne constantă și egală cu Tm, în ciuda faptului că substanța este dată la căldură (Figura 1). Nu este posibilă încălzirea cristalului la T> Tm în condiții obișnuite, în timp ce în timpul cristalizării este relativ ușor să se obțină o supracolezire semnificativă a topiturii.
Topirea are loc cu absorbția căldurii latente a tranziției de fază - căldura de fuziune a Qpl.
Căldura specifică de fuziune qpl. arată cât de multă căldură este necesară pentru a converti complet 1 kg de materie din starea solidă în lichidul luat la temperatura de topire. QPL. = Qpl. / m, J / kg.
Topirea este însoțită de o schimbare a proprietăților fizice ale materiei: o creștere a entropiei, care reflectă dezordinea structurii cristaline a materiei; creșterea capacității termice, rezistența electrică. Practic la zero, rezistența la forfecare scade în timpul topirii, viteza de propagare a sunetului (valuri longitudinale) etc. scade.
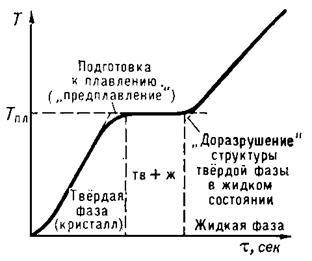
Fig. 1. Opriți temperatura la topirea unui corp cristalin.
Abscisa este timpul # 964; proporțional cu cantitatea de căldură uniform aplicată corpului.
Conform reprezentărilor cinetice moleculare, topirea se realizează după cum urmează. Când rezumând o căldură cristalină a corpului crește vibrațiile energetice (amplitudinea vibratiilor) a atomilor săi, ceea ce conduce la o creștere a temperaturii corpului și promovează formarea unui cristal de diferite tipuri de defecte (neumplut cristaline puncte zabrele - poziție; tulburări de periodicitate a atomilor zăbrele, infiltrați între nodurile sale, etc. . Cristalele moleculare pot fi dereglare parțială a orientării reciproce a axelor moleculare atunci când moleculele nu au o formă sferică. o creștere graduală a numărului de defecte caracteriza asocierea lor pas pretopire. Odată cu realizarea Tm în defectele cristaline create concentrație critice incepe plavlenie- pauze de cristal cu zăbrele în jos în Curgătoare regiunea submicroscopic. Căldura furnizată în topirea corpului nu vine la încălzirea și ruperea legăturilor interatomice și distrugerea de ordine cu rază lungă în cristale. ei înșiși ca zone submicroscopice de ordine cu rază scurtă în aranjamentul atomilor în timpul topirii nu se modifică în mod semnificativ. Acest lucru explică valorile inferioare QPL căldură de topire în comparație cu căldura de vaporizare și o mică schimbare într-un număr de proprietăți fizice ale substanțelor atunci când acestea se topesc. Pe măsură ce crește temperatura, moleculele se mișcă tot mai intens. Când este încălzit, nu numai că mărește energia moleculară cinetică a corpului, dar, de asemenea, energia potențială a atomilor săi, deoarece odată cu creșterea oscilațiilor de amplitudine atomi distanță de o distanță mai mare și se apropie unul de altul la o distanță mai scurtă, astfel încât energia de interacțiune a crește lor sarcină electrică. Cu creșterea temperaturii se produce în final un astfel de moment în menținerea ordine între atomii pendulare puternic devine imposibilă și distrugerea rețelei cristaline pornește de la acest punct, rezultând decolorare și ordine cu rază lungă. Solidul se topește.
În corpurile amorfe, schimbarea temperaturii cu timpul nu are o secțiune cu o temperatură constantă, ci doar un punct de inflexiune. O creștere a temperaturii unui corp amorf solid este însoțită de o scădere continuă a vâscozității acestuia.
Trecerea inversă a materiei într-o stare solidă este posibilă atât din stare lichidă, cât și din cea gazoasă. În acest sens și în celălalt caz o tranziție are loc de la o stare lipsită de simetrie, în starea în care există simetrie (acest lucru se aplică ordinul cu rază lungă, care apare în cristale și în care nici lichidele nici gaze). Prin urmare, trecerea la o stare solidă trebuie să apară brusc la o anumită temperatură, spre deosebire de tranziția lichid-vapori, care poate apărea continuu. Procesul de formare a unui corp solid, cu lichid de răcire este un proces de formare a cristalului (cristalizare), și are loc la o anumita temperatura - temperatura de cristalizare. Întrucât în această transformare energia sistemului scade, o astfel de tranziție trebuie să fie însoțită de eliberarea energiei sub formă de căldură de cristalizare. Din legea conservării energiei rezultă că căldura topirii și căldura de cristalizare trebuie să fie egale una cu cealaltă.