Fiecare moleculă, ion sau radical liber, având doar electroni localizați, poate fi reprezentată de o formulă electronică numită structura Lewis, care arată localizarea acestor electroni. În formulele Lewis, numai electronii de valență indică - ei pot intra într-o legătură covalentă sau pot fi împărțiți. Pentru a scrie structurile Lewis, folosiți următoarele reguli generale:
1. Numărul total de electroni de valență într-o moleculă (precum și într-un ion sau radical) trebuie să fie egal cu suma tuturor electronilor carcasei exterioare, plus o încărcătură pozitivă sau minus negativă în cazul ionilor.
2. Electronii împărțiți (fie unul, fie o pereche) formează o parte din carcasa exterioară a unui singur atom, iar electronii implicați în formarea legăturii covalente fac parte din carcasa exterioară a acestor doi atomi. Atomii elementelor din a doua perioadă nu pot avea mai mult de opt electroni de valență (regula octet). În acele cazuri în care se pot construi structuri cu numărul de electroni de valență pentru atomi, mai puțin de opt sau opt, se realizează structuri cu octet de electroni, deoarece au o energie mai mică. De exemplu, etilenă are o structură
O moleculă de oxigen are o structură biradical cu o energie mai mică decât structura dublei legături, dar în acest caz, fiecare atom de oxigen este prezent ca electronul opt electroni nepereche sunt plasate pe aceeași pentru ambele atomav -MOD, regula adică octetului este stocat.
3. De obicei, pentru fiecare atom indica o incarcatura oficiala. Se presupune că atomul are toți electronii nelegați, dar numai jumătate din electronii care participă la formarea legăturii covalenți. Excesul de electroni aparținând atomului provoacă o sarcină negativă, iar defectul este unul pozitiv.
electronegativitate
Electron nor atomului care leagă două identice, simetric (în raport cu planul de legătură intermoleculară împărțirea în jumătate), în toate celelalte cazuri, densitatea de electroni este deplasată mai la una dintre ele. Acest tip de atracție se numește electronegativitate. Se spune că atomul la care densitatea electronului este deplasat este mai mult electronegativ. Electronegativitatea atomilor depinde de natura, mediul și hibridizarea lor. Există diferite caracteristici cantitative ale electronegativității. Cea mai renumită este scara Pauling, bazată pe energiile obligatorii ale moleculelor diatomice. O energie de legare -B este luată ca medie aritmetică a energiei de legare a moleculelor A și B -A -B. Electronegativitatea astfel obținută va fi relativă. Pentru standard, să ia electronegativitatea elementului electronegativ - fluor. La această scară, un atom de fluor a fost atribuită electronegativitatea egal cu 4. Un electronegativitate al fiecărui element obținut din diferența dintre energia de legare adevărată A -B și valoarea mediei aritmetice a energiilor de legare ale A și formula B -A -B (diferența semnifica ) înseamnă:
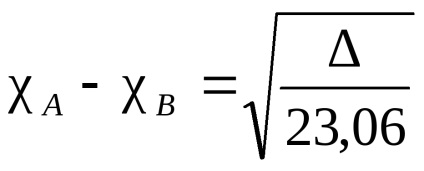
unde
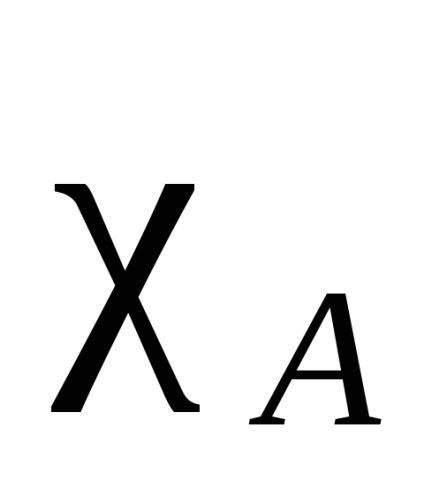
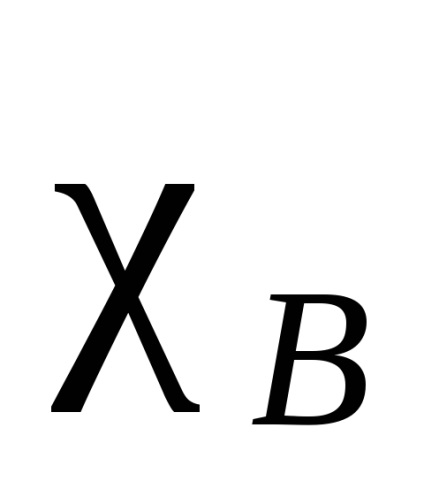
Alte abordări se bazează pe principii diferite. În unele dintre aceste abordări pot fi calculate pentru diferite stări de valență electronegativitate, diferite hibridare (atom de carbon sp este mai electronegativ decât 2. sp, care la rândul său este mai electronegativ decât sp 3) precum și atomi de carbon primar, secundar și terțiar. Mai mult, este posibil nu numai să se calculeze electronegativities de atomi, ci pentru grupele (Tabelul 1).
Tabelul 1. Electronegativitatea carbonului în funcție de mediu și hibridizare.