Se determină compoziția amestecului de reacție înainte și după reacție, luând în considerare randamentul produselor de reacție.
Faceți un tabel al balanței materiale.
1. Reacție chimică pentru calculul balanței materiale
NH4CI + NaOH = NaCI + NH3

2. Caracteristicile soluțiilor inițiale
CM (NH4CI) = 4 mol / l; mp-ra (NH4CI) = 2,3 kg; (NH4CI) = 1,065 g / ml;
CH (NaOH) = 2 mol / l; mp-ra (NaOH) = 2,5 kg; (NaOH) = 1,250 g / ml;
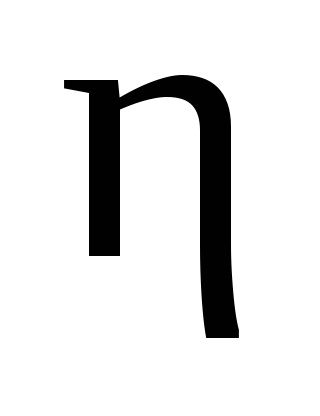
Vom calcula substanțele care intră în reacție
Vom calcula substanțele formate în reacție (produse de reacție) Consum:
Volumul soluției de NH4CI care se introduce:
Cantitatea de NH4CI din soluția de intrare:
Masa NH4CI în soluția de intrare:
Masa de apă în soluția de clorură de amoniu NH4CI:
Volumul soluției alcaline (NaOH):
Masa NaOH în soluția de intrare:
Cantitatea de NaOH din soluția de intrare:
Masa apei în soluție alcalină:
Cantitatea de NaOH reacționată ținând cont de randamentul produselor de reacție:
Alocarea 4. Se determină pH-ul mediului după reacție.
După terminarea reacției, soluția conține substanțe: NH4CI, NaOH, NaCI, amoniac parțial dizolvat. Reacția mediului poate fi influențată de NaOH și NH4CI hidrolizat.
mol / l, deoarece, atunci
Concentrația de ioni de hidrogen formată în timpul hidrolizei NH4CI este calculată prin constanta și gradul de hidroliză:
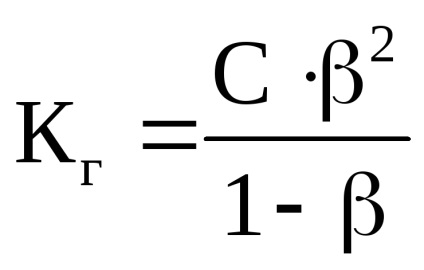
unde C este concentrația de sare, mol / l;

Deoarece gradul de hidroliză este mult mai mic decât unitatea, expresia are forma:
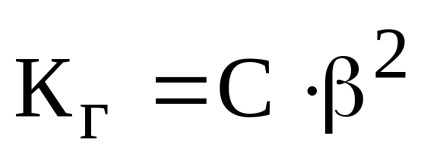
Constanta de hidroliză a unei sări a unei baze slabe și a unui acid tare este calculată prin formula:
,
.
Deoarece C (HCI) = C (NH4CI), atunci
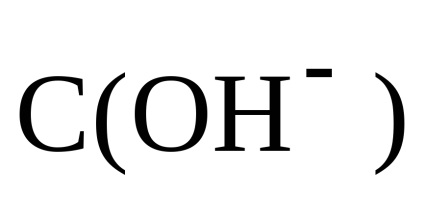
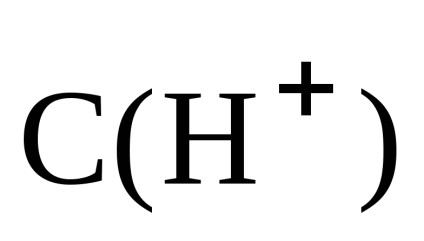
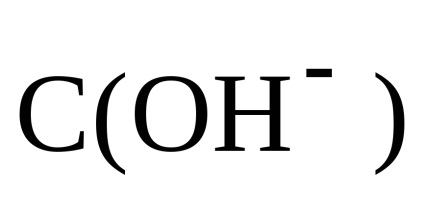
Prin urmare, pH-ul soluției se bazează pe concentrația de alcalii:
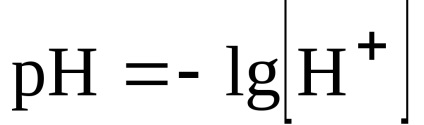
.
VARIANTELE SARCINILOR SEMESTRIALE PENTRU CINCEA