Luarea în considerare a elementelor pe care le vom începe cu subgrupul principal al celui de-al șaptelea grup - halogeni, care sunt non-metale tipice
§ 35. Particularitățile structurii atomice și moleculare a halogenurilor
Elementele grupului de halogenuri sunt foarte asemănătoare în proprietăți, deci ele sunt considerate împreună. Destul de diferit de celălalt fluor. "Halogeni" în traducere înseamnă "solide". Într-adevăr, toți halogeni - fluorura F, clorul CI, bromul Br și iodul I - formează săruri directe cu metale. Halogenul este, de asemenea, Astat At, descoperit în 1940.
Configurări electronice ale halogenurilor: F - 1s 2 2s 2 2p 5; Cl - 1s 2 2s 2 2p 6 3s 2 3p 5; Br - 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5; I - 1s 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 5.
Distribuția electronilor peste nivelele de energie ale halogenurilor în funcție de încărcătura nucleară Tabelul 11
Distribuția de-a lungul orbitalilor a electronilor stratului de electroni extern în toate halogeni este de același tip
Halogenii sunt multe similitudini în structura atomilor și moleculelor. Au completat stratul exterior de construcție p-shell, astfel încât toate dintre ele aparțin elementelor p. strat electronic extern de atomi de halogen până la finalizarea lipsa unui singur electron, deci electronegativitatea acestor elemente și se exprimă puternic în reacții redox ele se comportă în mod esențial ca oxidanți.
Moleculele de halogen sunt formate din doi atomi (F2, Cl2, Br2, 12) conectați printr-o legătură covalentă nepolară. Între atomii din moleculele de halogen există o pereche electronică comună. Acest lucru indică faptul că în substanțe simple aceste elemente sunt univalente. Spațiu cristalin de halogeni de tip molecular.
Atomii diferiților halogeni diferă în numărul de straturi de electroni și, prin urmare, razele atomilor de halogen sunt diferite (Tabelul 11). Pe măsură ce încărcăturile nucleare cresc, razele atomilor cresc, ceea ce duce la o scădere treptată a electronegativității de la fluor la iod și la o scădere a proprietăților nemetalice. Cel mai pronunțat nemetal dintre halogeni este fluorul, cel mai puțin luminos este iodul.
1. Cum se schimbă magnitudinea razei atomice ca o funcție a creșterii sarcinii nucleului atomic?
2. Ce tip de legătură chimică se află în moleculele de halogen?
3. Ce tip de rețea de cristal are halogenul?
4. Care este valența halogenilor în stare liberă?
5. De ce se formează o singură pereche de electroni când se formează o moleculă de halogen între atomi?
6. Cum se schimbă magnitudinea electronegativității cu razele de atomi în creștere? (Vezi răspunsul)
§ 36. Proprietățile fizice ale halogenurilor
Toate proprietățile de halogeni, fizice și chimice, depind de structura atomilor elementelor. Aceste proprietăți ale diferitelor halogeni sunt în mare parte similare, dar în același timp, fiecare halogen are un număr de caracteristici.
Fluorul este un gaz de culoare verde deschis, care are proprietati extrem de toxice. Punctul de fierbere al fluorului este -188 °, temperatura de solidificare este -218 °. Densitatea este de 1,11 g / cm3.
Clorul este un gaz de culoare galben-verde. Este, de asemenea, toxic, are un miros ascuțit, sufocant, neplăcut. Clorul este mai greu decât aerul, ușor de solubil în apă (1 volum de apă, 2 volume de clor), formând apă clor; Cl2agi la o temperatură de 34 ° se transformă într-un lichid și la 101 ° se solidifică. Densitatea este de 1.568 g / cm3.
Bromul este singurul lichid nemetalic. Această substanță este roșu-maro, greu, volatilă. Vasul în care se găsește bromul este întotdeauna colorat în perechi, într-o culoare maro-roșcat.
Bromul are un miros greu neplăcut ("brom" în traducere în rusă înseamnă "ofensator"). În apă se dizolvă slab, formând apă bromură Br2aq. Brut mult mai bine se dizolvă în solvenți organici - benzen, toluen, cloroform.
Dacă apa de brom pentru a creste o cantitate mică de benzen și se agită bine, se poate observa ca apa de colorare bromul dispare după lichide delaminare ca benzen adunat brom top pătată dizolvat într-o culoare portocaliu strălucitor. Acest lucru se datorează faptului că benzenul este extras din brom apă, datorită solubilității sale mai bine în benzen.
Depozitați bromul în sticle cu dopuri din sticlă și capace de pământ. Etanșările din cauciuc pentru lucrul cu brom, precum și pentru lucrul cu clor nu sunt aplicabile, deoarece corodează rapid. Bromul este mult mai greu decât apa (densitate 3,12 g / cm3). Punctul de fierbere al bromului este de 63 °, temperatura de solidificare este -7,3 °.
Iod - o substanță cristalină, gri închis, în perechi - violet. Densitatea iodului este de 4,93 g / cm3, punctul de topire este de 113 °, punctul de fierbere este de 184 °. Aducerea iodului în topire, și chiar mai mult la fierbere în condiții obișnuite, eșuează, deoarece chiar și cu o ușoară încălzire trece imediat din stare solidă în vapori - se fierbe. Trecerea materiei de la starea solidă la cea gazoasă, ocolirea lichidului și spatele se numește sublimare. Această proprietate este caracteristică nu numai a iodului, ci și a altor substanțe. Este convenabil să se utilizeze pentru curățarea substanțelor din impurități.
Iodul este slab solubil în apă. Culoarea apei de iod I2aq este întotdeauna galben deschis. Dar se dizolvă perfect în alcool. Acesta este utilizat pentru a prepara o soluție de iod în 5-10% în alcool, numită tinctură de iod. Iodul este, de asemenea, solubil în benzen, toluen, eter, disulfură de carbon și alți solvenți organici. Este interesant faptul că iodul se dizolvă foarte bine în soluția propriilor săruri, de exemplu în iodură de potasiu. Această soluție, numită soluție Lugol, este utilizată pe scară largă în laboratoarele clinice.
Dacă se adaugă un pic de benzen la apa iodică I2aq, atunci când este agitat, se formează de asemenea un inel de benzen colorat pe suprafață, dar numai de culoare purpuriu.
7. Cum se modifică intensitatea culorii halogenului cu creșterea tarifelor nucleare?
8. Care este numele soluțiilor de clor, brom și iod în apă?
9. Cum se modifică densitatea halogentelor cu creșterea tarifelor nucleare? (Vezi răspunsul)
10. Se compune și se completează tabelul "Proprietățile fizice ale halogeniilor" în conformitate cu următorul model:
11. Cum se explică punctele de topire și de fierbere scăzute ale halogenurilor în ceea ce privește structura grâului de cristal?
12. Care este densitatea relativă a fluorului și a clorului în aer și hidrogen? Dacă nu știți ce este densitatea relativă a gazelor, cum este determinată și cum se utilizează în calcule, consultați Anexa II, pagina 387. După aceea, veți putea răspunde la întrebare.
13. Cât de mult va lua 20 kg de clor în condiții normale? Dacă uitați să calculați volumul de gaz în condiții normale, consultați aplicația. (Vezi răspunsul)
§ 37. Acțiunea fiziologică a halogenurilor
Toți halogeni sunt otrăviți în efectele lor fiziologice. Fluoruri deosebit de toxice: atunci când sunt inhalate în cantități mici, cauzează edem pulmonar, în cazul distrugerii mari a țesutului pulmonar și a decesului.
Clorul este, de asemenea, o substanță foarte toxică, deși într-o măsură mai mică. În timpul primului război mondial, a fost folosit ca agent de război chimic, deoarece este mai greu decât aerul și bine ținut deasupra solului, în special în vremea fără vânt. Concentrația maximă permisă de clor liber în aer este de 0,001 mg / l.
otrăvirea cronică cu clor determină o modificare a culorii pielii, pulmonare si a bolilor bronșice. Când intoxicații cu clor ca un antidot care trebuie aplicat cu un amestec de vapori de alcool etilic și vapori de apă, cu un amestec de amoniac, care este necesară pentru a pre-elimina la aer curat.
În cantități mici, clorul poate vindeca afecțiuni ale căilor respiratorii superioare, deoarece are un efect dăunător asupra bacteriilor. Datorită efectului de dezinfectare, clorul este utilizat pentru dezinfecția apei de la robinet.
Vaporii de vapori provoacă sufocarea. Toxic și brom lichid, care provoacă arsuri grave pe piele. Transferul de brom dintr-o navă în alta este recomandat în mănuși de cauciuc și sub tracțiune.
În contact cu pielea, bromul trebuie spălat cu un solvent organic - benzen sau tetraclorură de carbon, frecându-l zona afectată cu vată de bumbac înmuiată cu acești solvenți. Când se clătește bromul cu apă, nu este neobișnuit să se evite arderea.
Iodul este cel mai puțin toxic din toți halogeni. Inhalarea vaporilor de iod în timpul încălzirii poate provoca intoxicații, dar este rar să lucrați cu iod de vapori, de exemplu, atunci când îl curățați prin sublimare. Iodul cristalin nu trebuie administrat manual, deoarece atunci când acesta intră pe piele provoacă apariția de pete galbene caracteristice. Toate lucrările cu halogeni trebuie efectuate într-o capotă de fum.
Cu toate acestea, halogeni sunt elemente vitale. Clor sub formă de sare de masă este utilizat în mod constant în produsele alimentare, precum și o parte a materiei plante verzi - clorofilă. Lipsa de fluor in apa de baut cauzeaza cariilor dentare. Iodul este esențial pentru toate organismele vii, atât plante și animale. Este implicată în reglarea metabolismului. La om, iodul este concentrat în principal în glanda tiroidă și este implicată în formarea hormonului său. Deficitul de iod determină modificări patologice ale glandei tiroide. Pentru a preveni bolile în produsele alimentare în cantități foarte mici, se adaugă iod, răspândirea câteva picături de tinctură de iod într-un pahar de apă, dar de multe ori sub formă de iodură de sodiu și iodură de potasiu.
• Scrieți în instrucțiunile de siguranță ale notebook-ului lucrul cu halogeni și primul ajutor pentru otrăvire.
§ 38. Proprietățile chimice ale halogenurilor
Prin natura proprietăților chimice, așa cum s-a menționat mai sus, toți halogeni sunt non-metali tipici care au o electronegativitate semnificativă. Cel mai electronegativ element cu cea mai mare activitate nemetalică este fluorul, iodul este cel mai puțin activ.
Interacțiunea dintre halogeni și substanțe simple. Este posibil să se urmărească scăderea activității chimice de la fluor la clor prin exemple de reacții diferite. Este deosebit de interesant interacțiunea diferiților halogeni cu hidrogenul. Condițiile de reacție sunt diferite pentru ei.
Astfel, fluorul reacționează cu hidrogenul cu explozie, chiar și în întuneric. În acest caz, fluorura de hidrogen este formată de ecuație.
H2 + F2 = 2HF
Fluorura de hidrogen este compusul cel mai durabil dintre halogenurile de hidrogen.
Interacțiunea dintre clor și hidrogen are loc cu o explozie numai în lumină:
Cl2 + H2 = 2 HCI
Dacă aprindeți un jet de hidrogen într-o atmosferă de clor, va arde într-o flacără calmă incoloră (Figura 21).
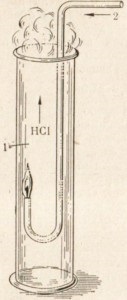
Fig. 21. Arderea hidrogenului în clor.
1- clor
hidrogen 2-
Cu hidrogen, bromul formează bromură de hidrogen.
Br2 + H2 = 2HBr
Procesul are o încălzire ușoară.
Iodul cu hidrogen reacționează numai când este încălzit pentru a forma iodură de hidrogen:
H2 + I2 = 2H1
Totuși, acest compus este foarte instabil și se descompune ușor cu formarea hidrogenului și a iodului. În toate aceste cazuri, halogeni se comportă ca oxidanți. Hidrocarburile halogenate formează acizi atunci când sunt dizolvați în apă.
Proprietățile de oxidare ale halogentelor se manifestă, de asemenea, atunci când interacționează cu metalele, care de obicei se desfășoară foarte activ.
Fluorul reacționează cu aproape toate metalele. Este ușor de urmărit interacțiunea heliului cu metalele. Multe metale în clor ard, de exemplu antimoniul se aprinde spontan (Figura 22). Alte metale reacționează cu clor la încălzire, de exemplu sodiu (figura 23).
2Na + Cl2 = 2NaCl
Dacă metalele pot avea un grad diferit de oxidare, atunci ele prezintă de obicei o reacție mai mare cu clorul. De exemplu.
2Fe + 3CI2 = 2FeCI3
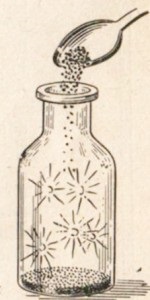
Fig. 22. Autofluziunea antimonului în clor
Aici, fierul reacționează cu clorul într-o stare de oxidare de +3 - Fe +3. iar cuprul este egal cu + 2-Cu +2. În toate cazurile de mai sus, clorul se comportă ca un oxidant.
Reacționează violent cu metalele și cu bromul. Dacă un tub de turnare cu brom lichid chipsuri bit din aluminiu, acestea sunt arse în brom, cu formarea de bromură de aluminiu, care este însoțită de eliberarea de vapori de brom brun și scântei. Reacția se desfășoară conform următoarei ecuații:
2Al + 3Br2 = 2AlBr3
Experimentul este realizat în dispozitivul prezentat în Fig. 24. Tubul lung 1 servește drept răcitor de aer. De asemenea, bromul arde staniu. antimoniu. și potasiu cu brom, dă o explozie puternică.
Iodul reacționează de asemenea cu metale pentru a forma săruri de iodură. Mai ales interesant este reacția aluminiului cu iodul. In acest scop, cristale de iod se triturează într-un mojar pentru a forma o pulbere fină și apoi iod amestecat grila asbestirovannoy cu praf de aluminiu. Amestecul, vasele și materialele trebuie să fie complet uscate. Dacă se adaugă apoi la un amestec de picătură de apă, care este un catalizator în acest proces, amestecul se aprinde și arde, alocând cluburi violet vapori de iod
2Al + 3I2 = 2AlI3
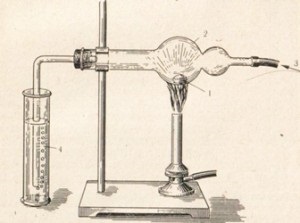
Fig. 23. Arderea de sodiu în clor.
Sodiu 1-metal
Tub 2-clorocarbon
3- clor
4-potasiu caustic
Trebuie remarcat faptul că iodul reacționează cu metalele mai dificil decât clorul și bromul.
Spre deosebire de majoritatea altor halogeni substanță simple în interacțiune directă cu oxigenul nu intră, ca halogeni și oxigen au valori similare electronegativitate. În același timp, compușii cu halogen de oxigen sunt obținuți indirect și există.
■ 14. Demonstrați prin compilarea unui echilibru electronic care, în reacțiile cu hidrogenul și metalele, halogenul se comportă ca oxidanți. Justificați acest comportament prin structura atomului de halogen.
15. Ce volum de acid clorhidric se poate obține prin reacția cu hidrogenul de 20 litri de clor? (această problemă este rezolvată integral în volume).
16. Pentru ca clorura de hidrogen rezultate să nu fie contaminată cu clor, interacțiunea clorului cu hidrogenul acestuia din urmă are 5% mai mult decât cantitatea necesară. Calculați cantitatea de hidrogen obținută pentru a obține 50 de litri de acid clorhidric. (Vezi răspunsul)