Delocalizarea orbitalilor moleculari în metale
Cum pot electronii să treacă printr-o bucată de metal? Care este diferența dintre un metal și un dielectric? Ce sunt semiconductorii? De ce se încălzesc metalele atunci când electronii se mișcă? Ce este supraconductivitatea?
Pentru a răspunde la primele trei întrebări, este necesar să se extindă discuția orbitali moleculare extinse pe care le-am găsit în moleculele de compuși aromatici, cum ar fi benzen și naftalen (vezi cap. 18) pentru MO bucăți macroscopic metal și alte materiale. Pentru a răspunde la ultimele două întrebări vor trebui să se mute din discuția efectului vibrațiilor termice ale atomilor care alcătuiesc o bucată de metal, pentru a discuta despre miscarea electronilor din metal.
Capitolul 10 al moleculei de hidrogen în discuție, am aflat că doi atomic orbital a hidrogenului se combină pentru a forma două orbitali moleculare - lipirea și antibonding. În cazul benzenului, am văzut că cele șase orbitalii pz atomice - unul din fiecare atom de carbon - volumetrico lipirea și trei antibonding MO. La zece pz naftalină orbitali atomici se combină pentru a forma zece MO - care leagă cinci și cinci dezintegrare. În fiecare caz, Ministerul Apărării acoperă întreaga moleculă. În capitolul 11, dedicat tabelului periodic al elementelor, am spus ca sodiu (Na) este un metal, deoarece are un electron (3s) peste neon configurație coajă închisă. Na acest lucru dă cu ușurință un electron pentru a forma săruri cum ar fi sarea de masă NaCl. NaCl se dizolvă în apă și se transformă în ioni de Na + și Cl -. După cum sa menționat deja, în stare solidă este Na metalic și un comportament de energie electrică, iar acum suntem gata pentru a explica de ce.
Să analizăm mai întâi orbitele celor doi atomi de sodiu, care sunt adiacente unul altuia și interacționează. În sodiu, electronul 3s este valent, adică participă la formarea legăturilor. În partea superioară a Fig. 19.2 prezintă nivelele energetice ale a două orbite atomice 3s care se combină în orbitale moleculare. Nivelul energetic al unuia dintre aceste MO este mai mic decât cel al orbitalilor atomici. Acesta este un MO obligatoriu. Un alt MO are un nivel mai ridicat de energie - acesta este un orbital relaxant. În partea de mijloc a figurii, se vede că trei orbite atomice formează trei MO. Situația cu șase atomi de sodiu interacțioși este prezentată mai jos. Șase orbite atomice 3s sunt combinate în șase MO - trei legare și trei dezintegrare.
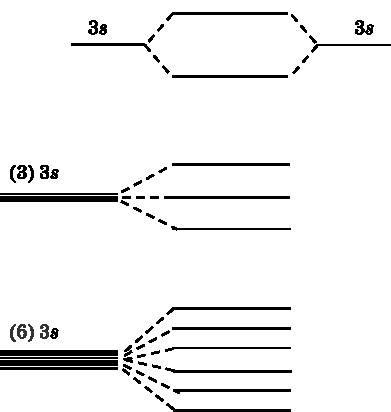
Fig. 19.2.Vverhu: interacționa 3s-doi orbitali atomici de sodiu și a genera două orbitali moleculari - unul cu un consum redus de energie (legare) și una cu o mai mare (antibonding). In mijlocul a trei orbitali atomici 3s reacționează și formează trei MoS. La parter: șase orbitali nuclear-3 sunt combinate în șase MI
Fiecare atom de Na are un electron 3s, care va merge pentru a umple MO. Într-un sistem cu șase atomi de sodiu, vor exista șase electroni pentru a umple MO. Fiecare MO poate accepta doi electroni cu rotiri opuse (unul îndreptat în sus, celălalt în jos). De aceea, trei MOO cu cele mai mici energii, adică legăturile MO, vor fi umplute cu electroni. Trei MO cu energii mai mari vor rămâne goale.
Acum trebuie să ne gândim la ce se va întâmpla în cazul unui număr foarte mare de atomi de sodiu care interacționează. Luați o tijă de 10 cm lungime și 1 mm în diametru. constând din sodiu (a se vedea figura 19.1). La astfel de dimensiuni, numărul atomilor de Na care vor conține tija va fi N = 2 • 10 21 (două miliarde trilioane) de atomi de Na. Două miliarde de trilioane de atomi 3s-orbitale sunt combinate în două miliarde de miliarde de ortalii moleculare. Ca și în cazul benzenului MO și naftalinei, MO a tijei de sodiu ar trebui considerată propagatoare în întregul sistem, adică la întreaga bucată de metal.