Mn2 + ionul de mangan nu are o culoare în soluția apoasă. Îndepărtarea a doi electroni de pe orbitele 4s nu afectează stările interne ale electronilor d, care sunt doar cinci în mangan și fiecare ocupă una din cele cinci stări posibile. Cu toate acestea, gradele mai mari de oxidare afectează deja puternic aceste electroni.
Cristale MnSO4 sau MnSOz incolor (uneori MnSOz roz deschis), dar oxid MnO gri-verde, MnSl2 și Mn (NO3) 2 roz. Dacă în apă de mare crește concentrația de mangan, aceasta afectează formarea de corali, perle și perle. În Japonia, există plantații subacvatice speciale, în care se formează perele cu perle - moluște bivalve. În aceste organisme, straturile lamelare de aragonit sunt depuse pe suprafața interioară a cojilor - una dintre formele cristaline de carbonat de calciu (al doilea, calcit, a fost menționat în legătură cu stalactite). Dacă aceste straturi conțin ioni de mangan, straturile încep să dobândească o nuanță roz și apare o perlă roz. Includerea altor ioni în ele dă o tentă gălbuie, iar foarte rar perlele sunt chiar negre. Deoarece perlele sunt compuse din carbonat de calciu, pot apărea și în peșterile subterane. În peșterile din Novy Afon, asemenea perle au fost găsite într-o cantitate destul de mare.
Gradul de oxidare a manganului +3 corespunde culorii maro de Mn2O3 sau negru-maro în Mn3O4. Este adevărat că ultima conexiune conține nu numai Mn3 +, dar și Mn4 +, care adâncește culoarea. În condiții normale, MnO2 este cristale negre. Ionul Mn6 + poate fi prezent numai în anionul MnO42, verde colorat. Citratul H2MnO4, corespunzător acestui anion, nu este izolat în formă liberă, ci este format din săruri după acidificarea soluțiilor de manganat:
K2MnO4 + 2CH3COOH → H2Mn04 + 2CH3S0K
spontan se descompune în MnO2 maro închis și KMnO4 permanganat:
ZK2MnO4 + 4CH3COOH -> MnO2 + 2KMnO4 +
Anionul MnO4-, unde gradul de oxidare a manganului este cel mai mare + 7, corespunde unei culori diferite - violet-purpuriu. Toată lumea a văzut-o probabil - este culoarea soluției de "mangan".
Această varietate de culori mangan compuși personal timp-oxidare și combinația lor simultană în soluție permisă K. Scheele numit K2MnO4 cameleon mineral. În 1774, cercetătorul a obținut manganat de potasiu prin fuziune:
Mn02 + 2KOH + KNO3, → K2Mn04 + KNO2 + H2O
Produsul de reacție cu apă a dat o soluție verde, dar treptat la picioare în aer (sub acru natur) a fost transformată mai întâi în albastru, apoi în Fiol tovy și în final a devenit roșu aprins (colorarea MnO4-).
O astfel de varietate de culori se datorează unei schimbări în caracterul ionilor de mangan. Cu cât este mai mare gradul de oxidare, cu atât este mai mare efectul polarizant al manganului. Este vorba de faptul că Mn + 6 și Mn + 7 sunt unul dintre oxidanții puternici. Ele selectează ionul de oxigen din apă, creând un mediu de patru ioni de O-2. Diferența în starea unui singur electron determină culoarea - verde sau violet-crimson, dar în plus - capacitatea oxidativă.
Ceva similar se întâmplă cu ionii de crom. Cromul hidratat Cr2 + este albastru. Acesta este unul dintre cei mai puternici reductori. Este instabil nici în soluție, nici în compoziția unui solid. Unul dintre compușii săi relativ stabile (în absența aerului) este acetatul de Cr (CH3O2) 2. Acțiunea polarizantă a ionului Cr2 + este de așa natură încât acetatul dobândește o culoare roșie. Ion Cr2 + ne -rata tinde la Cr3 +, care are o culoare diferită în soluție - verde, iar unii dintre compușii săi - violet (de exemplu, SrS1z). Prin oxidarea cu peroxid de sodiu, cromul poate fi transformat în cea mai înaltă stare de oxidare +6:
2NaCrO2 + 3Na2O2 + 2H2O → 2Na2CrO4 + 4NaOH
O astfel de SR6 + ion pot fi incluse în două anion pis Lot: crom - N2SrO4 și dicromat - N2Cr2O7. Fiecare dintre ele are propriul colorant: primul - galben, iar cel de-al doilea - portocaliu. Traduceți dintr-o formă în alta, puteți adăuga acid sau alcaline:
2CrO4- + 2H + → H20 + Cr2O72-
Cr2O72- + 2OH- → 2CrO42- + H20
În mod natural, cromul, care este puternic oxidat, este un agent puternic de oxidare:
K2Cr2O7 + 3C2H5OH + 4H2SO4 → CH3CHO + Cr2 (SO4) 3 +
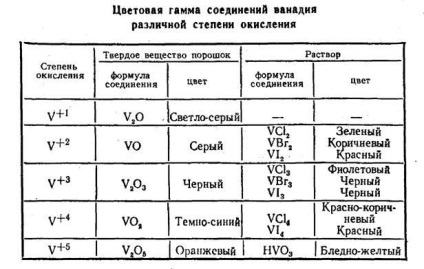
Gradul de oxidare este determinat de starea electronilor de valență. Fiecare grad de oxidare corespunde culorii și caracterului propriu. Din ionul albastru instabil +2 cu proprietăți de reducere la Cr6 + - oxidant trece o gamă completă de culori. Schimbarea proprietăților ionului și schimbarea culorii au aceeași bază - starea definită a electronilor. Trecerea de la un grad de oxidare la alta face ca sistemul de electroni al ionului sensibil la lumina cuantica a unei energii strict definite, care corespunde diferentei dintre energia d-subsilevels. Diversitatea culorii stărilor ionice ale aceluiași element dovedește că această diferență este destul de subtilă. Există scheme de culoare similare pentru alte elemente de tranziție. De exemplu, să menționăm schimbarea culorii compușilor solizi-oxizi și soluții ale halogenurilor de vanadiu (Tabelul 2).
Modificarea culorii soluțiilor în funcție de gradul de oxidare este, de asemenea, caracteristică pentru metale nemetalice. Astfel, iodul în stare liberă are o culoare violet. În acidul sulfuric 100%, soluția de iod are o culoare roz, corespunde ionului complex I3 +. Acest complex constă dintr-o moleculă de iod și cationul I + adsorbit pe ea, Când se adaugă un oxidant:
2I3 + + HIO3 + 8H2S04 = 7I + + 3H3O + + 8HS04-
Culoarea soluției, în care ionul I + este în principal prezent, devine albastru închis.
Mediul afectează culoarea
Cationii, anionii în soluție sunt înconjurați de o coajă a rastvoritelya. Stratul de astfel de molecule, imediat adiacent ionului, se numește coajă de solvat (din cuvântul solver - se dizolvă). Numărul de molecule care intră aici este dificil de determinat. Cu toate acestea, suntem interesați de un efect diferit al solvației.
În soluții, ionii pot acționa nu numai unul asupra celuilalt, ci și asupra moleculelor solventului ce le înconjoară și a celor care, la rândul lor, au ioni. Când se dizolvă și ca rezultat al solvației, apare culoarea ionului anterior incolor. De exemplu, CuF2 și CuSO4 anhidru sunt albe, iar soluțiile lor sunt colorate în albastru. Aceasta este culoarea ionului de cupru hidratat. În împrejurimile sale imediate, ea include ca mini-mum șase molecule de apă. Patru dintre ele sunt conectate cu el ferm și două - slab. Înlocuirea mediului ionic de la ionii F- și SO4-deficient deformabili la moleculele de apă ușor polarizabile conduce la apariția culorii. Scoaterea apei (de exemplu, prin evaporare) duce la precipitarea hidraților cristalini de aceeași culoare. La urma urmei, ele conțin molecule de apă. Astfel, un hidrat cristalin de sulfat de cupru CuSO4 • 5H2O patru din cele cinci molecule sunt aranjate în jurul unui ion de cupru și o cincime ocupă o poziție intermediară și este conectat atât cu Cu2 +, și dintr-un grup de SO42- (fig. 11).
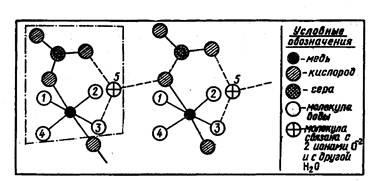
Fig. 11. Schema structurii hidratului cristalin al vitriolului la modă. O moleculă de CuSO4 · 5H2O este cuprinsă în cadru. Bara înseamnă că molecula H2O este conectată cu doi ioni de oxigen și o altă moleculă de apă.