Trecerea unui metal dintr-o stare lichidă într-o stare solidă (cristalină) se numește cristalizare.
Cristalizarea pro-Tek în condițiile în care sistemul trece la o stare mai stabilă termodinamic cu energie mai mică Gibbs (ei fără energie) G, r. E. Când energia Gibbs a cristalului este mai mică decât energia Gibbs a fazei lichide.
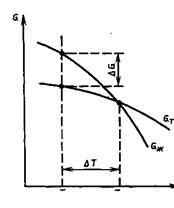
Dacă transformarea are loc cu o mică schimbare de volum, atunci G = E - TS, unde E este energia totală (energia fazei interne), T este temperatura absolută și S este entropia.
Modificarea energiei Gibbs a unui metal în stare lichidă și solidă în funcție de temperatură este prezentată în Fig. Deasupra temperaturii Tn, un metal lichid cu o rezervă mai mică de energie liberă este mai stabil, iar sub această temperatură este un metal solid. La o temperatură Tn, energiile Gibbs ale metalului în stare lichidă și solidă sunt egale. Temperatura Tn corespunde temperaturii de echilibru a cristalizării (sau topirii) unei substanțe date, în care ambele faze (lichide și solide) pot coexista simultan. Procesul de cristalizare la această temperatură încă nu începe. Procesul de cristalizare se dezvoltă dacă sunt create condiții în care există o diferență în energiile Gibbs G, formată ca urmare a unei energii inferioare Gibbs a unui metal solid în comparație cu cea lichidă.
În consecință, procesul de cristalizare poate fi realizat numai atunci când metalul este subcoolat sub temperatura de echilibru Tn. Diferența dintre temperaturile Tn și Tk la care poate avea loc procesul de cristalizare se numește gradul de supracoolizare:
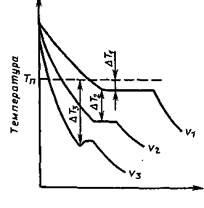
Curbele termice care caracterizează procesul de cristalizare a metalelor pure la răcire cu viteze diferite v sunt prezentate în Fig. 19. Cu o răcire foarte lentă, gradul de supracolire este mic și procesul de cristalizare are loc la o temperatură apropiată de temperatura de echilibru Tn (figura 19, curba a). Pe curba termică la temperatura de cristalizare, se observă o platformă orizontală (oprirea căderii de temperatură), formarea căreia se explică prin eliberarea căldurii latente de cristalizare, în ciuda transferului de căldură în timpul răcirii.
Pe măsură ce rata de răcire crește, gradul de supracoolizare crește, iar procesul de cristalizare are loc la temperaturi situate cu mult sub temperatura de cristalizare a echilibrului. Cu cât metalul lichid este mai curat, cu atât este mai predispus la hipotermie. Atunci când se solidifică metalele foarte pure, gradul de supracolire poate fi foarte ridicat. Cu toate acestea, mai des, gradul de subrăcire nu depășește 10-30 ° C.
Procesul de cristalizare, după cum a stabilit DK Chernov pentru prima dată, începe cu formarea de nuclee cristaline (centre de cristalizare) și continuă în procesul de creștere a numărului și dimensiunilor lor.
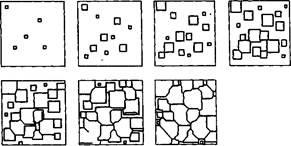
Fig. 20. Schema de cristalizare a metalului
Atunci când aliajul este subcoolat sub temperatura Tn, în multe regiuni ale aliajului lichid stabil se formează embrioni cristalini
În timp ce cristalele formate cresc în mod liber, ele au o formă geometrică mai mult sau mai puțin regulată. Cu toate acestea, în coliziunea cristalelor în creștere, forma lor corectă este perturbată, deoarece în aceste zone se încetează creșterea fețelor. Creșterea continuă numai în acele direcții în care există acces liber la lichidul "hrănit". Ca rezultat, cristalele în creștere, care inițial aveau o formă geometrică corectă, după solidificare, au o formă exterioară neregulată și, prin urmare, sunt numite cristalite sau granule.
Fenomenele care apar în procesul de cristalizare sunt complexe și diverse. Este deosebit de dificil să ne imaginăm etapele inițiale ale procesului, când se formează primul lichid cristal sau centrul de cristalizare.
În metalul lichid care este pur de impurități, cele mai mari fluctuații de heterofază se transformă în embrioni (centrele de cristalizare).
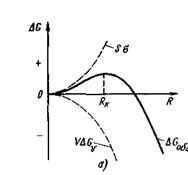
Creșterea embrionilor este posibilă numai dacă au atins o anumită valoare, din care creșterea lor duce la o scădere a energiei Gibbs. În procesul de cristalizare Ener ogy-sistem Gibbs, pe de o parte, a redus de V # 916; GV datorită trecerii unui volum de taliu UI lichid în solid, iar pe de altă parte, creșterea formării interfeței cu energia de suprafață în exces egală cu S # 963; Schimbarea totală a energiei Gibbs poate fi determinată din următoarea expresie:
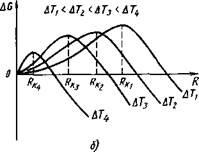
Cu cât valoarea embrionului este mai mică, cu atât este mai mare raportul dintre suprafața sa și volum și, prin urmare, cea mai mare parte a energiei totale este în energia de suprafață. Schimbarea energiei Gibbs a unui metal Gobsch în timpul formării embrionilor cristalini, în funcție de mărimea lor R și gradul de supracoolizare este prezentat în Fig. 22, a.
Când se formează un embrion mai mic decât RK (figura 22, b), # k. rk. rk. RKT ristemy energie crește libere, deoarece incrementarea energiei Gibbs datorită formării unei noi suprafețe se suprapune reducerea acesteia prin formarea de nuclee metalice solide, t. E. Volume Gibbs energie. În consecință, un embrion mai mic decât RK nu poate să crească și să se dizolve într-un metal lichid. Dacă se dezvoltă un embrion,
Modificare - GV este proporțională cu volumul R3, incrementul S # 963; este proporțională cu suprafața R 2. unde R este dimensiunea nucleului sferic.
Cu o creștere a dimensiunii sale, energia Gibbs a sistemului scade.
Dimensiunea minimă a embrionului este Rc. care este capabilă să crească în condiții de temperatură date, se numește dimensiunea critică a embrionului, iar embrionul în sine este critic sau echilibrat.
La o temperatură apropiată de TP, mărimea nucleului critic trebuie să fie foarte mare, iar probabilitatea formării acestuia este mică. Cu o creștere a gradului de supracolire, cantitatea GV crește, iar valoarea tensiunii de suprafață la interfața de fază variază nesemnificativ.
În consecință, cu o creștere a gradului de supercoolizare (sau cu o scădere a temperaturii de cristalizare) dimensiunea nucleului critic scade și munca necesară pentru formarea acestuia va fi mai mică. În legătură cu aceasta, cu o creștere a gradului de supra-răcire, când embrionii cu o dimensiune tot mai mică devin capabili să crească, numărul de embrioni (centre) de cristalizare și rata de formare a acestor embrioni cresc foarte mult.
Creșterea embrionilor are loc ca urmare a trecerii atomilor de la lichidul supracolicitat la cristale. Cristalul crește stratul cu strat, fiecare strat având o grosime monatomică.
Cu cât gradul de supercoolizare este mai mare, cu atât este mai mare magnitudinea acestui nucleu critic bidimensional și cu cât este mai ușor să se formeze.
Într-un cristal în creștere există întotdeauna dislocări. La punctul de ieșire de pe suprafața de dislocare a șurubului, există o etapă, la care atomii care vin din lichid sunt ușor atașați. Displaziile de șurub conduc la formarea spiralelor de creștere de la unul la mai multe mii de atomi de pe suprafața cristalului. Creșterea spirală a fost observată experimental în studiul creșterii singularelor cristale de magneziu, cadmiu, argint și alte metale. În acest caz, nu este necesară formarea unui embrion bidimensional.
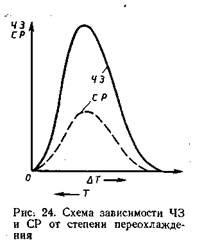
Numărul de centre de cristalizare și rata de creștere a cristalelor. Ceteris viteză paribus cristalizare și structura metalică după călire depinde de numărul de gâturi-RW originea (nucleatie) apărute în unitatea-VRE Meni și pe unitatea de volum, adică. E. De la skerospgobrazovaniya originea (mm
x) și viteza de creștere (CP) a embrionilor sau a ratei de creștere a dimensiunilor liniare ale cristalului în creștere pe unitate de timp (mm / s). Cu cât rata de nucleare și creștere este mai mare, cu atât mai rapid are loc procesul de cristalizare. La o temperatură de cristalizare a echilibrului Tn, numărul de embrioni și viteza de creștere sunt zero și astfel nu are loc cristalizarea. Prin creșterea gradului de subrăcire a ratei nucleația și rata de creștere a unui coș de fuzibil, un anumit grad de subrăcire este atins maxim-ma, după care a redus. Cu o creștere a gradului de supercoolizare, rata de formare a nucleului și, prin urmare, numărul acestora, crește mai rapid decât rata de creștere. Un astfel de caracter al variației lui R3 și CP în funcție de gradul de supracolire este explicat prin următoarele. Ca gradul de diferență subrăcire în energia Gibbs de metal crește lichid-solid, care există metode, creșterea vitezei de cristalizare, adică. E. Rata de nucleaŃie și creștere. Cu toate acestea, pentru formarea și dezvoltarea nucleelor, este necesară difuzia atomilor în metalul lichid. În legătură cu aceasta, datorită scăderii ratei de difuziune, la grade înalte de supracoolizare (temperaturi scăzute), formarea nucleilor și creșterea lor sunt împiedicate. În consecință, numărul de embrioni și rata creșterii lor scad. La temperaturi foarte scăzute (grad ridicat de re-răcire) mobilitatea difuzia atomilor este atât de mic încât bolshoy- volum câștig Gibbs energie după cristalizare-TION nu este suficientă pentru formarea de cristal-cristaline nucleelor și creșterea (H3 = O, SR = 0). În acest caz, după întărire trebuie realizată o stare amorfă.
Dimensiunea cerealelor. Cu cât rata de nucleare este mai mare și cu cât ritmul de creștere este mai lent, cu atât este mai mică dimensiunea cristalului (boabele) cultivată dintr-un embrion și, prin urmare, structura metalului va fi mai fin.
Cu un grad redus de răcire superioară (rată scăzută de răcire), numărul de embrioni este mic. În aceste condiții, se va produce un boabe mari. Cu o creștere a gradului de supracolire, rata de formare a nucleelor crește, numărul acestora crește, iar dimensiunea granulelor în metalul solidificat scade.
Dimensiunea granulelor unui metal afectează puternic proprietățile sale mecanice. Aceste proprietăți, în special vâscozitatea și ductilitatea, sunt mai mari dacă metalul are o granulație fină. Amploarea cerealelor depinde nu numai de gradul de supracolire. Temperatura încălzirii și turnării unui metal lichid, compoziția sa chimică și, în special, prezența impurităților străine, influențează dimensiunea cerealelor.