Definiția lui F.Engels "Viața este o modalitate de existență a corpurilor de proteine" nu și-a pierdut corectitudinea și relevanța după aproape un secol și jumătate.
Proteinele se află în rădăcina structurii oricărui organism și toate reacțiile vitale care au loc în el. Orice încălcare a acestor proteine duce la o schimbare în sănătate și sănătate. Nevoia de a studia structura, proprietățile și tipurile de proteine constă în diversitatea funcțiilor lor.
Proteinele formează substanța țesutului conjunctiv - colagen. elastina. keratina. proteoglicani. Direct implicat în construcția membranelor și citoscheletului ?? eta (integral și proteine de suprafață poluintegralnye) - spectrin (superficial bază de proteine eta eritrocit citoscheletului ??), glicoforin (integral, fixează spectrin pe suprafață), această funcție K poate fi atribuită în parte crearea organite - ribozomi.
Toate enzimele sunt proteine. Dar, în același timp, există date experimentale privind existența ribozimelor, ᴛ.ᴇ. acid ribonucleic cu activitate catalitică.
Reglarea și coordonarea metabolismului în diferite celule ale corpului se realizează prin hormoni. Unele dintre acestea sunt proteine, de exemplu, insulină și glucagon.
Această funcție constă în legarea selectivă a hormonilor, a substanțelor biologic active și a mediatorilor pe suprafața membranelor sau a celulelor interioare.
Numai proteinele efectuează transferul de substanțe în sânge. de exemplu, lipoproteine (grăsimi de transfer), hemoglobina (transportul de oxigen), transferină (transport de des ?? eza) sau prin membrane - Na +, K + -ATPaza (transport transmembranar opus ionilor de sodiu și de potasiu), Ca 2+ ATPază ( pomparea ionilor de calciu din celula).
Ca exemplu de depozitare a proteinelor, se poate menționa producția și acumularea în ou a albuminei din ou. Nu există astfel de depozite specializate la animale și la oameni, dar cu foamete prelungite, proteine de mușchi, organe limfoide, țesuturi epiteliale și ficat.
Există o serie de proteine intracelulare destinate să modifice forma celulei și mișcarea celulei în sine sau organele sale (tubulină, actin miozină).
Funcția de protecție în infecții are imunoglobulinele din sânge, cu leziuni tisulare - proteine ale sistemului de coagulare a sângelui. Proteoglicanii sunt protejați mecanic și sprijiniți de celule.
Proteina este o secvență de aminoacizi legați împreună prin legături peptidice.
Este ușor de imaginat că numărul de aminoacizi ar trebui să fie diferit: de la un minim de două până la orice valori rezonabile. Biochimii au fost de acord să considere că, dacă numărul de aminoacizi nu depășește 10, atunci un astfel de compus este denumit de obicei o peptidă; dacă 10 până la 40 de aminoacizi sunt o polipeptidă. în cazul în care mai mult de 40 de aminoacizi sunt proteine.
Molecula de proteine liniare, formată prin legarea aminoacizilor în lanț, este structura primară. Din punct de vedere figurativ, poate fi comparat cu un fir comun pe care au atârnat până la câteva sute de margele de douăzeci de culori diferite (prin numărul de aminoacizi).
Succesiunea și raportul aminoacizilor din structura primară determină comportamentul ulterior al moleculei: capacitatea acesteia de a se îndoi, de a curba, de a forma anumite legături în sine. Formele de molecule create în timpul coagulării pot lua în mod consecvent nivelul secundar, terțiar și cuaternar al organizației.
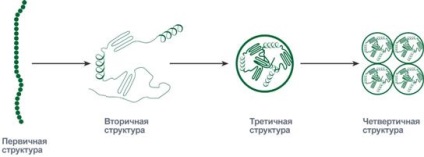
Reprezentarea schematică a secvenței de ambalare a proteinei în structura cuaternară
La nivelul structurii secundare, "margelele" de proteine sunt capabile să se potrivească sub forma unei spirale (similară cu arcul ușii) și sub forma unui strat pliat. atunci când "margelele" sunt stivuite cu un șarpe și părțile îndepărtate ale margelelor sunt următorul.
Plasarea proteinei în structura secundară continuă cu ușurință la formarea unei structuri terțiare. Acestea sunt globule separate, în care proteina este ambalată compact, sub forma unei bobine tridimensionale.
Unele globule de proteine există și își îndeplinesc funcția nu numai, ci în grupuri de două, trei sau mai multe bucăți. Astfel de grupuri formează o structură cuaternară a proteinei.
Combinarea aminoacizilor prin intermediul legăturilor peptidice creează un lanț polipeptidic liniar, denumit în mod obișnuit structura primară a proteinei.
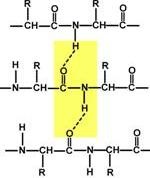
Porțiune din lungimea lanțului proteic de 6 aminoacizi (Ser-Cys-Tyr-Leu-Glu-Ala) (legături peptidice izolat ?? Enes galben aminoacizi - cadru roșu)
Structura primară a proteinelor, ᴛ.ᴇ. secvența de aminoacizi din acesta este programată de o secvență de nucleotide din ADN. Depunerea, inserția, înlocuirea unei nucleotide în ADN conduce la o schimbare în compoziția de aminoacizi și, în consecință, la structura proteinei sintetizate.
Dacă modificarea secvenței aminoacizilor nu este letală, ci adaptivă sau chiar neutră, noua proteină poate fi moștenită și rămâne în populație. Ca rezultat, apar noi proteine cu funcții similare. Acest fenomen este denumit în mod obișnuit polimorfismul proteinelor.
De exemplu, cu anemie cu secera în poziția a șasea - o schemă de hemoglobină, acidul glutamic este înlocuit cu valină. Acest lucru duce la sinteza hemoglobinei S (HbS) - o hemoglobină, care în forma de deoxi polimerizează și formează cristale. Ca urmare, eritrocitele sunt deformate, iau forma unei secera (banana), pierd elasticitatea si, atunci cand trec prin capilare, sunt distruse. Acest lucru duce în cele din urmă la o reducere a oxigenării țesuturilor și a necrozei.
Raportul acidului secvență și de aminoacizi în structura primară definește un secundar de formare. terțiar și cuaternar.
Structura secundară a proteinei este modul de ambalare a catenei polipeptidice într-o structură mai compactă, la care grupările peptidice interacționează cu formarea de legături de hidrogen între ele. Formarea structurii secundare este cauzată de dorința peptidei de a accepta o conformație cu cel mai mare număr de legături între grupările peptidice. Tipul structurii secundare depinde de stabilitatea legăturii peptidice, de mobilitatea legăturii dintre atomul de carbon central și carbonul grupării peptidice și mărimea radicalului aminoacid.
Toate acestea, cuplate cu secvența de aminoacizi, vor conduce ulterior la o configurație de proteine definită strict.
Se pot distinge două variante posibile ale structurii secundare: # 945; - helix (# 945; -structura) și Stratul acoperit (# 946; -structura). Într-o proteină, de regulă, ambele structuri sunt prezente, dar în proporții diferite. În proteine globulare predomină # 945; - helix, în cele fibrilare; # 946; -structura.
Structura secundară este formată numai cu participarea unor legături de hidrogen între grupurile de peptide: un grup de atom de oxigen reacționează cu atomul de hidrogen al doilea, în timp ce al doilea hidrogen oxigen grup peptidă se leagă la a treia, etc.