Stările Valence ale atomilor de carbon.
Atom C im-m charge +6.
La ultimul nivel de energie conține 4 atomi de carbon de electroni, dintre care două ocupă având o formă sferică orbital 2S-, iar doi electroni ocupa 2p orbitali având forma gantelepodobnuyu. Atunci când este excitat, un electron din orbitele 2s poate trece la una din orbitele 2p vacante. Această tranziție necesită unele costuri de energie (403 kJ / mol). Ca rezultat, atomul de carbon excitat are 4 electroni neparticipati si configuratia sa electronica este exprimata prin formula 2s 1 2p 3
Carbon excitat: 1s22s12px12py12pz1
Hibridizarea este un fenomen al reciprocității reciproce a orbitalilor moleculari care sunt aproape de energie și au elemente comune de simetrie, cu o serie de orbite hibride cu energie mai mică.
sp3-hibridizarea (1 stare de valență a carbonului): caracter pentru o serie omologă de metan.
Legăturile chimice care apar în metan la atomii de carbon și hidrogen sunt de tipul respectiv # 948; - conexiuni (sp 3-s-conexiune). - combinațiile dintre carbon și hidrogen sunt formate de nori hibrid sp3 și de nori de hidrogen. Principala diferență Conexiunile dintre celelalte sunt că suprapunerea orbitalilor se realizează de-a lungul liniei care unește nucleele atomilor.
sp2-hibridizare (valență 2 atomi de carbon), mod-Xia în interacțiunea și doi orbitali p (Px și py) și orbital s-și sp2-orbitali formate se află într-un plan și unghiul mod-m de 120 °. Caracteristic pentru seria omologă de etilenă.
Legătura dublă este completă de orbitali sp2 hibridizați, iar n-legătura este determinată de p-orbitale nehybridizate.
sp-hibridizare (starea de valență 3 a atomului de carbon): obrysya pentru o interdependentă și s-orbitală cu orbital px.
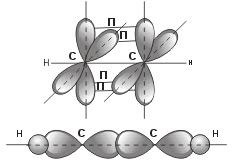
Pentru hibridizarea sp, orientarea liniară a orbitalilor moleculari. Har-na pentru seria omologă de acetilenă. - se leagă de un nod hibrid sp de carbon într-un plan, iar 4 nori de electroni p formează două n-linii în planuri reciproc perpendiculare.
Estimarea distribuției densității electronilor în moleculele org-in. Metode de transfer al atomilor electronici vzdadyaniya.
Toți atomii care alcătuiesc molecula sunt legați și au o influență reciprocă. Această influență este transferată, în principiu, la sistemul de legături covalente, cu așa-numita legătură covalentă. efecte electronice. Efectele electronice se numesc schimbarea densității electronilor într-o moleculă sub influența substituenților.
Atomii conectați printr-o legătură polare poartă încărcături parțiale, denotate de litera greacă "delta" (# 948;). Deplasarea densității electronice de-a lungul unui lanț de legături CC simple se numește efect inductiv și este notată cu I.
Efectul inductiv este transmis de-a lungul circuitului cu atenuare. Direcția deplasării densității electronice a tuturor legăturilor s este indicată prin săgeți drepte.
În funcție de densitatea electronului din sau în apropierea atomului de carbon în cauză, efectul inductiv este numit negativ (-I) sau pozitiv (+ I). Semnul și magnitudinea efectului inductiv sunt determinate de diferențele de electronegativitate dintre atomul de carbon în cauză și grupul care îl provoacă.
Un atom "tragând" densitatea electronică a s-legăturii în direcția sa dobândește o încărcare negativă # 948; -. Când se ia în considerare o pereche de atomi legați printr-o legătură covalentă, atomul mai electronegativ care se trage pe el însuși se numește acceptor. are un efect inductiv negativ. Partenerul său în conexiunea s va avea în consecință un deficit de densitate electronică egal în magnitudine, adică încărcare parțială pozitivă # 948; +, va fi numit donator. are un efect inductiv pozitiv.
+Efectul I arată radicali de hidrocarburi alifatice, adică radicalii alchil (metil, etil etc.). Majoritatea grupurilor funcționale prezintă efectul -I: halogeni, grupări amino, grupări hidroxil, carbonil, carboxil.
Efectul inductiv se manifestă și în cazul în care atomii de carbon legați sunt diferiți în starea de hibridizare.
Influența substituentului asupra distribuției densității electronice transmise peste legăturile p se numește efectul mezomer (M). Efectul mezomeric poate fi de asemenea negativ și pozitiv. În formulele structurale, este reprezentată de o săgeată curbată care începe în centrul densității electronice și se termină la punctul unde densitatea electronilor este deplasată.
Conjugarea este un fenomen al unui nor de electroni, comun pentru 3 sau mai mulți atomi de C.
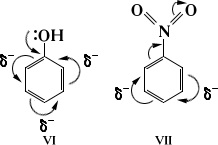
Prezența efectelor electronice conduce la o redistribuire a densității electronice în moleculă și la apariția încărcărilor parțiale pe atomii individuali. Aceasta determină reactivitatea moleculei.