EFECTE ELECTRONICE ÎN MOLECULELE COMPUȘILOR ORGANICE.
Efecte electronice - deplasarea densității electronice într-o moleculă,
ion sau un radical sub influența substituenților.
Orice atom (altul decât hidrogen) sau un grup de atomi este considerat a fi un substituent.
legat la un atom de carbon.
Există efecte electronice inductive și mezomerice ale substituenților.
Efectul inductiv (efect I) - deplasarea densității electronilor de-a lungul lanțului
s-legături, datorită diferențelor de electronegativitate a atomilor.
Din cauza polarizabilității slabe a legăturilor s, eu, efectul se distruge rapid cu distanța de la
și după 3-4 conexiuni devine practic egală cu 0.
Efectul inductiv este numit negativ (-I), în cazul în care substituentul reduce
Densitatea electronilor la atomul de carbon cu care este legat acest substituent.
În acest caz substituentul dobândește o sarcină negativă parțială (d-) și atomul
carbonul este o sarcină parțială pozitivă (d +). Direcția deplasării
Densitatea electronică a tuturor legăturilor s este notată cu săgeți drepte
(de-a lungul liniei de comunicare) și simbolurile încărcăturilor parțiale induse de substituent.
H3C d + ® Cl d - (- I este efectul atomului de clor)
-Efectul I se manifestă prin substituenți care conțin mai mult electronegativ
Efectul inductiv se numește pozitiv (+ I). dacă înlocuitorul
crește densitatea de electroni la atomul de carbon, inducând pe ea
o sarcină negativă parțială (d-), în timp ce ea însăși dobândește o taxă d +.
Exemplu: H3C d - Li d + (+ I - efect al atomului de litiu)
Efectul mezomeric (efect M) - deplasarea densității electronilor de-a lungul lanțului
delocalizate (conjugate) p (vezi secțiunea 4.10). Acest efect
se prezintă substituenții asociați cu atomul sp2- sau sp-hibridizat.
Datorită mobilității electronilor p, efectul M este transmis de-a lungul conjugatului
+Efectul M este posedat de substituenți care cresc densitatea electronului în
sistem conjugat. Acestea includ grupuri care conțin atomi cu
împărțită de o pereche de electroni, capabilă să transfere această pereche de electroni
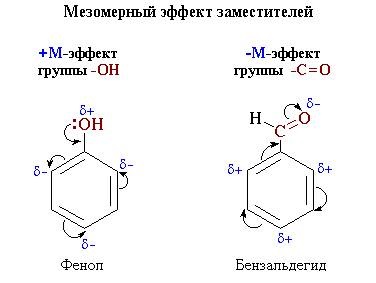
sistem comun de interfață. + Efectul M este caracteristic grupurilor -OH și -NH2
-Efectul M este expus de substituentii cu atomi electronegativi si
deplasând densitatea electronică pe ea însăși. - Efectul M este tipic pentru grupuri
-CH = O. -COOH. -NO2. Deși aceste grupuri au perechi de electroni împărțite în comun,
Aranjamentul spațial al orbitalilor cu acești electroni nu permite
ei trebuie să intre în sistemul de interfață. Astfel, în acest caz, substituentul
poate scoate numai electronii din sistemul comun de cuplare în detrimentul
electronegativitate mai mare.
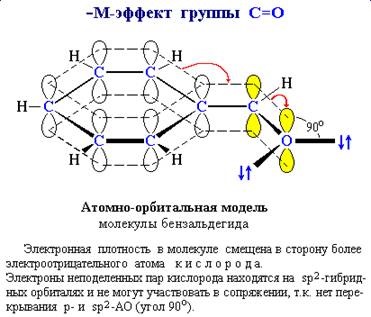
Pentru a determina semnul efectului M, este util să construim modele atomice-orbite.
reflectând orientarea spațială a orbitalilor și posibilitatea acestora
se suprapun (vezi secțiunea 4.9). Astfel, dacă p este orbita legăturii multiple C = O și
sp 2 - orbitali cu perechi de electroni împărțite în comun de atomi de oxigen
sunt perpendiculare unele pe altele, suprapunerea lor este imposibilă și
nici o pereche de electroni de oxigen nu poate fi transmisă către sistemul p.
Prin urmare, substituentul care conține grupa C = O nu arată + M.
a - efectul M (figura 6_4_1.
Direcția deplasării densității electronice sub influența efectului M
este marcat cu săgeți curbe (fig.6-4_2).