Fizica> Ce este entropia?
Entropia este o măsură a tulburării sistemului și a inaccesibilității energiei pentru realizarea muncii.
Obiectivul de învățare
- Determinați schimbarea entropiei într-un sistem cu proces inversabil.
Puncte cheie
- Raportul Q / T este schimbarea entropiei ΔS pentru un proces reversibil: ΔS = (Q / T) rev.
- Modificarea entropiei (ΔS) între cele două stări rămâne aceeași.
- O schimbare completă a entropiei pentru un sistem cu un proces reversibil este egală cu zero.
- Reversibilitatea este capacitatea de a reveni la starea inițială fără a aplica energie liberă și de a crește entropia.
- Ciclul Carnot este un proces teoretic în termodinamică.
Definiția entropy
Definiția în sine poate fi derivată din mecanismul Carnot. Pentru un ciclu și orice proces reversibil: Qc / Qh = Tc / Th. Din permutarea termenilor obținem Qc / Tc = Qh / Th (Qc și Qh sunt valorile absolute ale transferului de căldură la temperaturile Tc și Th). Raportul Q / T este schimbarea entropiei ΔS pentru un proces reversibil:
(Q este transferul de căldură, care este pozitiv pentru transferul de căldură și negativ pentru transferul de căldură, iar T este temperatura absolută pentru procesul reversibil).
Unitatea de entropie este J / K. Dacă schimbările au loc în timpul procesului la temperatură, atunci T este temperatura medie și nu are nevoie de utilizarea ΔS.
Utilizarea lui ΔS este justificată doar în procese reversibile, de exemplu în motorul Carnot. Dar pentru mecanisme reale, ΔS poate fi omisă. Faptul este că entropia depinde numai de starea sistemului. Aceasta va rămâne aceeași și nu depinde de modul în care sa produs schimbarea. Trebuie doar să găsim un proces reversibil și să calculam ΔS.
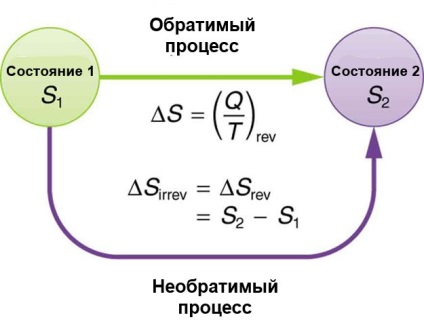
Când sistemul schimbă starea, entropia se modifică cu aceeași valoare ΔS, indiferent dacă a fost un proces reversibil sau ireversibil
Să aruncăm o privire asupra modificărilor din motorul Carnot și ale rezervoarelor sale de căldură într-un ciclu complet. Rezervorul fierbinte își pierde entropia: ΔSh = -Qh / Th. Pentru un coeficient rece, ΔSc = Qc / Tc. Se pare că schimbarea totală a entropiei:
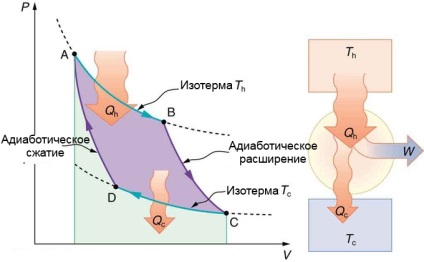
Numai procesele reversibile izoterme și adiabatice sunt folosite aici. Transferul de căldură Qh intră în substanța activă pe durata căii izotermice AB la o temperatură stabilă Th. Transferul de căldură se efectuează în timpul traseului CD izotermic la un marcaj de temperatură Tc. Apoi W este egal cu zona din interiorul căii - ABCDA. De asemenea, este prezentată o diagramă a motorului Carnot care funcționează între rezervoarele fierbinți și răcite cu Th și Tc
Știm că Qh / Th = Qc / Tc pentru motorul Carnot, prin urmare:
Aceasta înseamnă că o schimbare completă a entropiei în orice proces reversibil este echivalentă cu un exponent zero.