Dintre toate comune apa lichid - cel mai versatil solvent lichid, cu valori maxime ale tensiunii superficiale, constanta dielectrică, și căldură mare de vaporizare (după amoniac) o căldură de topire. Spre deosebire de cele mai multe substanțe, apa, înghețarea la presiune joasă se extinde.
Aceste proprietăți specifice ale apei sunt asociate cu structura specială a moleculei sale. Formula chimică a apei H2O este înșelătoare. Într-o moleculă de apă, nucleele atomilor de hidrogen sunt dispuse asimetric în raport cu nucleul atomului de oxigen și a electronilor. Dacă atomul de oxigen este în centrul unui tetraedru, centrele de masă ale celor doi atomi de hidrogen sunt la colțurile unui tetraedru, iar centrele de încărcare a două perechi de electroni ocupă celelalte două unghiuri (figura 1.1). Astfel, patru electroni sunt localizați la cea mai mare distanță posibilă atât de nucleul atomului de oxigen, cât și de nucleele atomilor de hidrogen, la care sunt încă atrase de nucleul atomului de oxigen. Ceilalți șase electroni ai moleculei de apă sunt aranjați astfel: patru electroni sunt într-o poziție care asigură o legătură chimică între atomii de oxigen și atomii de hidrogen, iar celelalte două sunt situate în apropierea nucleului atomului de oxigen.
Aranjamentul asimetric al atomilor moleculei de apă determină distribuția neuniformă a sarcinilor electrice în ea, ceea ce face ca molecula de apă să fie polară. Această structură a moleculei de apă cauzează atragerea de molecule de apă reciproc ca rezultat al formării legăturilor de hidrogen între ele. Aranjamentul atomilor de hidrogen și oxigen în interiorul agregatelor formate de molecule de apă este similar cu aranjamentul atomilor de siliciu și oxigen din cuarț. Aceasta se referă la gheață și într-o măsură mai mică la apa lichidă, agregatele moleculelor care se află întotdeauna în stadiul de redistribuire. Atunci când apa este răcită, moleculele sale sunt grupate în agregate, care cresc treptat și devin mai stabile pe măsură ce se apropie de temperatura de 4 ° C, când apa atinge o densitate maximă. La această temperatură, apa nu are încă o structură rigidă și, împreună cu lanțurile sale lungi de molecule, există un număr mare de molecule de apă individuale. Cu răcirea suplimentară, lanțurile moleculelor de apă cresc datorită adăugării de molecule libere la acestea, ca urmare a scăderii densității apei. Când apa se transformă în gheață, toate moleculele sale intră într-o structură mai mult sau mai puțin rigidă sub formă de lanțuri neînchise care formează cristale.
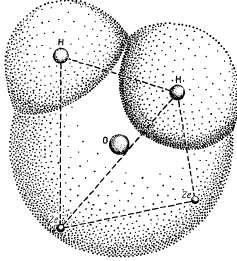
Penetrarea reciprocă a atomilor de hidrogen și oxigen. Miezurile a doi atomi de hidrogen și două perechi de electroni se află în colțurile tetraedrului: nucleul atomului de oxigen este situat în centru.
Valorile ridicate ale tensiunii superficiale și căldura de evaporare a apei sunt explicate prin faptul că separarea moleculei de apă de un grup de molecule necesită o cheltuială relativ mare de energie. Dorința moleculelor de apă de a stabili legături de hidrogen și polaritatea lor explică puterea de dizolvare a apei neobișnuit de mare. Unii compuși, cum ar fi zaharurile și alcoolii, sunt reținuți în soluție datorită legăturilor de hidrogen. Compușii care posedă un grad ridicat de inducere a ionizării, de exemplu clorura de sodiu, sunt reținuți în soluție, deoarece ionii cu încărcături opuse sunt neutralizați de grupuri de molecule de apă orientate.
Moleculele de apă H2O sunt construite sub forma unui triunghi: unghiul dintre două legături de oxigen-hidrogen este de 104 de grade. Dar, deoarece ambii atomi de hidrogen sunt localizați pe o parte a oxigenului, încărcăturile electrice din acesta sunt dispersate. Molecula de apă este polară, care este motivul pentru interacțiunea specială dintre diversele sale molecule.
Atomii de hidrogen din molecula H2O, având o sarcină parțială pozitivă, interacționează cu electronii atomilor de oxigen ai moleculelor învecinate. O astfel de legătură chimică se numește o legătură hidrogen. Combină moleculele de H2O în polimeri specifici ai structurii spațiale; plan în care legăturile de hidrogen sunt aranjate perpendicular pe planul atomilor în aceeași moleculă H2 O. Interacțiunea dintre moleculele de apă și a explicat în principal punct de topire ridicat neregulat și punctul său de fierbere. Este necesar să se adune energie suplimentară pentru a se agita și apoi să se distrugă legăturile de hidrogen. Și această energie este foarte semnificativă. De aceea, capacitatea de căldură a apei este atât de mare.
Ca majoritatea substanțelor, apa constă în molecule și ultimul în atomi.
Structura atomului este următoarea: în jurul nucleului protonului încărcat pozitiv la anumite niveluri de-a lungul orbitelor diferite, electronii încărcați negativ care formează mișcarea norului de electroni. Numărul de electroni din fiecare coajă pentru atomul fiecărui element este strict determinat. Deci, atomul de hidrogen are o singură coajă cu un singur electron și atomul de oxigen are două cochilii: o carcasă interioară cu doi electroni și o cochilie exterioară cu șase.
Două atomi de hidrogen înlocuiesc locul de vacanță a doi lipsiți (până la opt) de electroni ai cochiliei exterioare pentru stabilitatea sa. Se poate presupune că un atom de oxigen și doi atomi de hidrogen dintr-o moleculă de apă formează un unghi de aproape 180 ° față de atomul central de oxigen. Cu toate acestea, în realitate este mult mai mic - doar 104 ° 27 „(figura 1.2), ceea ce conduce la forțe de compensare intramoleculare incomplete, ceea ce generează asimetrie exces distribuție de sarcină care creează polaritatea moleculelor de apă. Această polaritate în apropierea apei, care este mai semnificativă decât cea a altor substanțe, determină momentul dipolului și constanta dielectrică. Acesta din urmă lângă apă este foarte mare și determină intensitatea dizolvării apei de diferite substanțe. La 0 ° C, constanta dielectrică a apei (în faza solidă) este de 74,6; cu o creștere a temperaturii scade.
Astfel, la 20 ° C, constanta dielectrica a apei este de 81. Ce inseamna asta? Aceasta înseamnă că două încărcături electrice opuse în apă sunt atrase reciproc cu o forță egală cu
1/80 a interacțiunii lor în aer și că separarea ionilor de cristalele oricărei săruri în apă este de 80 de ori mai ușoară decât în aer.
Numeroase scheme de structură a moleculei de apă sunt ipotetice, construite pe observații indirecte prin dispozitive ale unor semne de comportament și proprietăți ale moleculelor și atomilor. Trebuie amintit faptul că nici un atom sau molecule nu au limite clare, din cauza incertitudinii atât forma și dimensiunile exacte ale orbitelor în care electronii se deplasează, formând de fapt nor de electroni, în funcție de starea energetică a unui electron. Acesta din urmă poate fi calm sau excitat, care depinde, în special, de temperatură. Prin urmare, diferența dintre valorile razei calculate, precum și natura schematică a modelelor ipotetice de atomi și molecule.