Experimentele lui Rutherford privind studiul împrăștierii

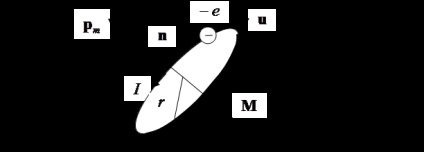
Un electron care se deplasează pe o orbită circulară formează un dipol magnetic (a se vedea figura 7.7).
De la încărcare




unde



unde




ix ?? Hotarat. Raportul dintre momentul magnetic al unei particule elementare și momentul său mecanic se numește de obicei raportul magnetomecanic (sau giromagnetic).
Pentru mișcarea orbitală a unui electron, raportul gyromagnetic este
Din fig. 7.7 că proprietățile magnetice ale fiecărui atom sunt legate de rotația mecanică a electronilor în jurul nucleului. Acest fapt se află în baza fenomenelor magnetomecanice: magnetizarea magnetului duce la rotirea sa și, dimpotrivă, rotirea magnetului provoacă magnetizarea acestuia.
Apariția rotației unui magnet în timpul magnetizării lui a fost găsită experimental în experimentele Einstein și de Haas (vezi Figura 7.8).
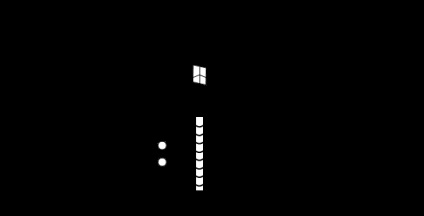
Un arbore galben subțire, suspendat pe un fir elastic, a fost plasat în interiorul solenoidului. Când tija este magnetizată într-un câmp magnetic constant al unui solenoid cu curent, filamentul se transformă într-un unghi mic. Pentru a spori efectul, solenoidul nu a fost alimentat de o constantă, ci de un curent alternativ la o frecvență egală cu frecvența naturală a oscilațiilor mecanice ale sistemului. Amplitudinea oscilațiilor de rezonanță a fost măsurată cu o oglindă fixată pe filament. Din experiment, raportul gyromagnetic al electronului a fost estimat, ÿᴏᴛᴏᴩᴏᴇ în modulul a fost de aproape 2 ori mai mare decât datorită mișcării orbitale a electronului din (7.16), adică,
Același rezultat pentru magnitudinea raportului gyromagnetic al electronului a fost obținut în experimentul Barnett. Tija de jeleu a fost adusă într-o rotație foarte rapidă. În acest caz, tija a fost magnetizată. Explicarea experienței: un electron rotativ este similar cu un giroscop. Când tija sa rotit, fiecare astfel de giroscop, împreună cu el, a primit o rotație forțată suplimentară. În acest caz, axa de rotație a fiecărui giroscop tind să se orienteze în direcția rotației forțate.
Se poate observa că rezultatul experimental (7.17) nu este de acord cu teoretic așteptat (7.16) pentru mișcarea electronică orbitală. Explicația discrepanței a fost dată în teoria cuantică: electronul, ca și alte particule elementare, are propriul său moment mecanic (spin)


Concluzie Proprietățile magnetice ale fierului, precum și ale altor feromagneți, nu se datorează orbitalului, ci momentelor magnetice intrinseci ale electronilor.
Spinul particulelor elementare se dovedește a fi un număr întreg sau jumătate integrantă a constantei Planck

Momentul magnetic al atomului este compus din vectori ai momentelor orbitale și intrinseci magnetice ale electronilor și ale momentului magnetic al nucleului. Momentul angular al nucleului constă în momentele magnetice ale protonilor și neutronilor care intră în el. Momentul magnetic al nucleului este de obicei mic în comparație cu momentul magnetic al electronului. Când se iau în considerare multe fenomene, momentele magnetice ale nucleelor nu sunt luate în considerare.
În experimentele lui Stern și Gerlach (vezi figura 7.9), momentele magnetice ale atomilor au fost măsurate experimental. Un fascicul de atomi a fost trecut printr-un câmp magnetic puternic neomogen. Neomogenitatea câmpului a fost asigurată de o formă specială a pieselor polului electromagnetului.

Într-un câmp neomogen, atomii fasciculului acționează

unde



Din cauza mișcării termice a unghiurilor



Concluzie Unghiurile de orientare a momentelor magnetice ale atomilor față de direcția câmpului magnetic pot lua doar valori discrete, adică proiecția momentului magnetic pe direcția câmpului magnetic este cuantificată.
Măsurătorile au arătat că momentele magnetice ale atomilor pot atinge valori de ordinul mai multor magnetoni Bohr

