Materiile prime, semifabricatele și produsele finite din producția de fermentație au reacție acidă; numai melasa are de obicei o reacție ușor alcalină. Aciditatea este de obicei exprimată în centimetri cubi dintr-o soluție normală de alcalii, care este utilizată pentru neutralizarea acizilor în 100 cm3 sau 100 g de produs.
În producția de alcool, aciditatea este exprimată în grade de aciditate, i. E. numărul de centimetri cubi ai unei soluții normale de alcalină necesară pentru a neutraliza soluția de 20 cm3; în timp ce 1 cm3 din soluția normală de alcalii, consumată pentru a neutraliza 20 cm3 din soluție, corespunde unui grad de aciditate. Aciditatea berei este exprimată în centimetri cubi dintr-o soluție normală de alcalii, care este utilizată pentru a neutraliza 100 cm3 de bere. Aciditatea totală este determinată prin titrare în prezența unui indicator. În controlul tehnico-chimic al plantelor de fermentație, ca indicator sunt utilizați metilorange, roșu de metil, albastru de bromtimol, fenolftaleină, litmus. Caracteristicile acestor indicatori sunt prezentate mai jos.
Tabelul 6 - Caracteristicile indicatorilor
Zona de tranziție a culorii (pH)
La determinarea luminii de aciditate și produse transparente să ia o anumită cantitate de soluție de testat a fost adăugat câteva picături de indicator și se titrează cu 0,1 N soluție normală sau alcalină înainte de o schimbare a culorii. Pentru a determina produsele aciditate întunecoase (zaharificat mash masă matură și altele) un anumit volum de soluție de testat se titrează cu alcali, în procesul de titrare luând ocazional o picătură de soluție de testare de pe placa de porțelan, indicator adăugat se agită cu o baghetă de sticlă și observarea culorii. Conform cu numărul necesar pentru titrarea acidității alcaliei sunt comune.
Aparate și reactivi. Măcinare de laborator; sită nr. 08; baloane conice pentru 100-150 cm3; plăci de sticlă de 20x20; Soluție de NaOH 0,1 N; Soluție 1% de fenolftaleină; roșu fenolftaleină (20 picături de apă distilată sunt adăugate 10 picături de fenolftaleină 1% și 4 picături de NaOH 0,1 N, soluția este preparată zilnic).
Determinarea acidității șuvoiului (GOST 10844) / 8 /
Metoda se bazează pe titrarea unei suspensii de cereale măcinate cu o soluție de alcalină 0,1 N în prezența fenolftaleinei. Atunci când se titrează, alcalina este legată nu numai de substanțele acide care au trecut în soluție, ci și de substanțele particulelor de făină, astfel încât aciditatea ciocului este ceva mai mare. Rezultatele depind într-o mare măsură de finețea măcinării, deci trebuie verificate.
Cursul definiției. Din proba medie a granulei luat 50 g de orz a fost purificată prin gunoi (deteriorate stânga boabe) și măcinate într-o moară, astfel încât toate cereale măcinate deținute prin sitare printr-un tifon sită № 08. Făina a fost plasată pe o placă de sticlă, sub agitare, distribuite uniform așa că, după alte plăci pridavlivaniya transformat strat de făină nu mai gros de 3-4 mm. Prin eliminarea sticlei superioare luat nu mai puțin de 10 locuri, și 5 g de făină se cântărește cu o precizie de ± 0,01 g probă cântărită se transferă într-un balon Erlenmeyer uscat la 100-150 cm3 50 cm3 de apă distilată (mai întâi în porțiuni mici până complet umezire), se agită bine până la dispariția bulgărilor, apoi se clătește cu pereți particulele de făină de apă. Piureul se adaugă 5 picături de soluție de fenolftaleină 1% și se titrează cu agitare 0,1 N soluție alcalină până la o colorație roz distinct nu dispare după repaus timp de 1 minut.
În cazul în care beater are o culoare intensă, un alt bolt din această probă de orz este pregătit și, la titrare, schimbarea de culoare este comparat cu culoarea inițială a gândacului.
Aciditatea (în grade) se calculează prin formula
unde a este un volum de 0,1N. soluție de alcaline, a trecut la titrare, cm3;
K este factorul de corecție pentru titrul soluției alcaline 0,1 N;
n - balama de făină, g;
100 - factor de conversie pentru 100 g orz;
10 - factor de conversie al soluției de 0,1 N soluție alcalină în soluție 1 N.
Pentru aciditatea reală, se ia media aritmetică a celor două determinări paralele, diferența dintre care nu trebuie să depășească (0,20.
Determinarea acidității titrabile în must și bere
Berea înainte de determinare se eliberează din dioxid de carbon, se agită sau se încălzește timp de 30 minute la 40 ° C, apoi se răcește la o temperatură de 200 ° C.
Cursul definiției. Într-un balon conic dozat 150-200 ml cu pipeta 50 ml de must sau bere și se titrează cu 0,1 N soluție alcalină, înainte până când 4 picături mustului (bere), amplasate pe o placă de porțelan, atunci când este amestecat cu 2 picături de fenolftaleină roșii nu încetează decolorant sale .
Aciditatea x (în ml de soluție 1 N alcalină per 100 ml de lichid) se calculează din formula
# 19; Ecuația EMBED.3 # 20; # 21; (14)
unde a este volumul de soluție 0,1N de alcaline, care a trecut la titrare, cm3;
b - volumul de must (bere), prelevat pentru titrare, ml;
10 - factor de conversie de 0,1N. soluție de alcaline în soluție 1 N.
Un exemplu. Pentru a se titra 50 ml de must, s-au utilizat 10,2 ml de soluție 0,1 N alcalină. Aciditatea mustului x = (10,2 (100)) (50 (10) = 2,04 ml de soluție 1 N alcalină per 100 ml de must.
Electrometrică sau titrare potențiometrică se bazează pe schimbarea bruscă a potențialului electrodului indicator în apropierea punctului de echivalență (titrare punct final (TKT), atunci când se adaugă la o soluție de o mică cantitate de reactiv de titrare. In reacțiile de neutralizare indicator poate servi ca diferite electrozi (antimoniu, sticlă, etc.), Potențialele de care depind pH-ului. ca electrozi de referință sunt cel mai des utilizate calomel și electrozii de clorură de argint. potențiometric titrare efectuate ispolz instrumente □ DN speciale (contoare pH, Titratori, potențiometre etc.). TKT poate fi determinat prin titrarea unei soluții sau la o valoare predeterminată de pH, sau până când acul galvanometrului deviate se oprește sau schimbă direcția abaterii. In general, se folosește prima metodă, folosind pH metri.
Valoarea pH adoptată pentru TBA este aleasă în funcție de pH-ul tranziției de culoare a indicatorului utilizat în titrarea convențională. Dacă în timpul titrării normale de utilizare fenolftaleină, titrare este terminat la un pH de 8,5, bromtimol albastru - la pH 7,3, turnesol - la 7.0, metil roșu - la pH 6,3, etc.
Titrarea electrometrică cu precizie egală poate determina aciditatea soluțiilor incolore și de culoare închisă.
Cursul definiției. Ceașca chimică pipetează 25 ml de must sau de bere, după care a fost titrat cu o soluție alcalină mixer 0,1N de lucru continuu, observând mișcarea galvanometru. La începutul titrare se adaugă soluția alcalină în porțiuni mici, și mai aproape de valoarea pH 8,5 - sub formă de picături. La sfârșitul titrării, citirea pe scala biuretei este scosă. Aciditatea se calculează din formula anterioară.
Determinarea acidității active (pH) în must și bere
Metoda electrometrică pentru determinarea pH-ului
Metoda se bazează pe faptul că atunci când electrodul este scufundat în soluție, ionii se schimbă între electrod și soluție, astfel încât pe electrod să apară un potențial, valoarea căreia depinde de concentrația ionilor de hidrogen din soluție. Aceasta poate fi măsurată dacă o celulă galvanică este formată dintr-un electrod a cărui potențial este măsurat (un electrod indicator) și un electrod auxiliar cu un potențial cunoscut (electrod de referință).
În prezent, sunt utilizați ca indicatori electrozii din sticlă și antimoniu, iar electrozii de clor-argint și calomel sunt utilizați ca electrozi de referință.
Determinarea pH-ului folosind pH-meter LPU-0.1
Principiul dispozitivului se bazează pe măsurarea EMF a unei celule galvanice formată dintr-un electrod de sticlă (indicator) și de clorură de argint (auxiliară). Scara dispozitivului este gradată în unități de pH și milivolți. Limitele de măsurare a pH-ului de la 2 la 14. Pentru a spori acuratețea măsurătorii, instrumentul are patru intervale cu limite înguste de pH. În aceste intervale, eroarea instrumentului nu depășește (1%, în intervalul de pH 2-14 - nu este mai mare (2,5% din domeniul de măsurare).
Dispozitivul (Figura 11) constă dintr-o celulă galvanică (senzor) și un contor. Toate părțile senzorului sunt asamblate pe un trepied. La capătul superior al trepiedului, se montează un electrod auxiliar care curge, plasat într-un vas de polietilenă. În partea inferioară a trepiedului există o masă mobilă pentru montarea unui geam cu soluție și electrozi. Contactul electric dintre cei doi electrozi se realizează printr-o coloană de soluție saturată de clorură de potasiu, care curge din vasul de polietilenă printr-un tub de cauciuc și un vârf de sticlă în soluția de testat. O soluție de clorură de potasiu încet (20 ml pe zi) curge prin bariera poroasă a vârfului, împiedicând astfel penetrarea ionilor străini din soluția de testare într-un vas cu un electrod auxiliar. Trebuie să vă asigurați că nu există bule de aer în tubul electrodului care rupe contactul. Electrodul și vârful de sticlă sunt atașate de braț cu cleme. Pachetul senzor conține un contact electrolitic pentru măsurarea pH-ului în soluții de până la 1 ml.
Pe panoul contorului (figura 12) există o scală care arată 5 valori ale pH-ului: de la 2 la 4, de la 2 la 6, de la 6 la 10, de la 10 la 14 și de la 2 la 14 și de la o scală pentru măsurarea EMF. Panoul afișează de asemenea toate butoanele de comandă ale instrumentului.
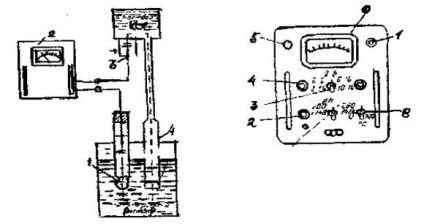
Figura 11 - Schema PH-meter LPU-01
2-panou al dispozitivului de măsurare;
3-flux electrod auxiliar;
4-vârf cu sept poros
Figura 12 - Panometru panou LPU-01 Comutator cu 1 manetă "Tipuri de lucru"; Priză de conectare pentru 2 senzori; Limite de măsurare a comutatorului 3; Buton de reglare 4 pentru soluție tampon; 5 - lampă de control; 6 scară; 7 - pornirea comutatorului; Compensator de temperatură cu 8 mâini
După ce dispozitivul a fost încălzit, acesta este ajustat la soluții tampon standard cu o valoare a pH-ului cunoscută.
Soluțiile tampon sunt preparate din fixatori speciali. Pentru ajustare, se ia o soluție tampon a cărei valoare pH este apropiată de pH-ul așteptat al soluției de testat. Soluția tampon se toarnă într-un pahar de laborator de 200 ml, un trepied tabel este retras la stânga, sub electrozi din sticlă con, este rotit și coborâtă pe paharul de masă ea. Masa este fixată la o înălțime astfel încât electrozii au fost imersate în soluție la o adâncime de 2-4 cm, limitele de comutare de măsurare stabilite împotriva intervalului de măsurare dorit și prin 0,5-1 minute tampon setări stilou soluție săgeată pe scara este alimentat la diviziunea, valoarea corespunzătoare a pH soluție tampon.
PH-ul soluției de testat este măsurat în ordinea adoptată la ajustarea instrumentului. Dacă pH-ul soluției este complet necunoscută, se produce mai întâi o determinare aproximativă, plasând limite comutator de măsurare la „2-14“ și luând count de scală gradată în unități de pH de la 2 la 14. Apoi, fără a schimba soluția, comutatorul este setat pentru a marca gama găsită pH-ul și numărarea îndepărtat prin scară corespunzătoare.
În intervalele de lucru, electrozii sunt păstrați în apă distilată, deoarece caracteristicile lor se schimbă atunci când se usucă. Când filmele apar pe electrozi, ele sunt spălate cu solvenți organici, soluții de acizi și alcalii și apoi cu apă distilată.
Eroarea instrumentului cu soluții tampon standard nu este mai mare de 0,02 pH, iar sensibilitatea nu este mai mică de 0,01 pH.
Verificarea unui dispozitiv nou sau a unui nou electrod de sticlă se efectuează pe soluții tampon în primele zile zilnice și ulterior - o dată pe săptămână.
În controlul producției, instrumentele sunt utilizate pentru a determina nu numai pH-ul, ci și aciditatea titrată prin metoda titrării electrometrice.
Înainte de începerea lucrului, electrozii sunt clătiți temeinic cu apă distilată și uscați cu hârtie de filtru. Senzorul este conectat la priza 2 utilizând un conector, dispozitivul este conectat, comutatorul 7 este pus în poziția "Pornit" (se aprinde lampa de control) și aparatul este încălzit timp de 30 de minute. Butonul de schimbare "Tipuri de lucru" este setat la poziția "pH", iar butonul de compensare a temperaturii este setat la temperatura dorită. Măsurătorile se efectuează la o temperatură de 20-30 ° C, deoarece la această temperatură abaterile în valorile pH-ului se află în cadrul erorii instrumentului.
Aciditatea activă în malț are un efect deosebit asupra proceselor enzimatice atunci când mashing și pH-ul în must este de obicei 5.5-5.6.
PH-ul mustului, la fel ca și mustul, este cauzat de ionii de hidrogen care trec din materia primă, precum și de interacțiunea chimică a cationilor și a anionilor cu apă și must.
În mustul sălbatic, aciditatea activă se situează în intervalul 5.3-5.5.