Toate substanțele constau din atomi și molecule care se mișcă și interacționează.
Substanțele simple constau din atomi identici, substanțe complexe - din atomi de diferite elemente chimice. Atomul este cea mai mică parte a elementului chimic, care este purtătorul proprietăților sale.
În centrul atomului se află un nucleu încărcat pozitiv, în jurul căruia se deplasează electronii încărcați negativ, atrași de nucleul încărcat pozitiv de forțele interacțiunii electromagnetice.
Caracteristica principală a unui element chimic este încărcarea nucleului unui atom.
Z - numărul de sarcină al nucleului, egal cu numărul de protoni din nucleu, coincide cu numărul atomic al elementului chimic din sistemul periodic al elementelor chimice ale DI Mendeleyev.
Atomul este neutru din punct de vedere electric. Încărcarea pozitivă (+ Ze) a nucleului este compensată de sarcina negativă (-Ze) a electronilor.
În plus față de protoni, nucleul atomilor conține neutroni asociați cu protoni puternici de interacțiune. Numele general al protonilor și neutronilor care alcătuiesc nucleul este nucleonii.
Numărul de masă A este egal cu numărul de nucleoni din nucleu (numărul total de protoni Z și neutroni N):
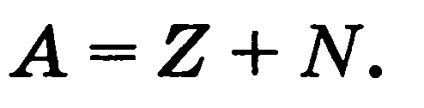
Izotopul - un fel de element chimic, al cărui atom conține același număr de protoni în nucleu și un număr diferit de neutroni.
În denumirea convențională a unui izotop al unui element chimic, numărul de masă A și numărul de încărcare Z sunt indicate:
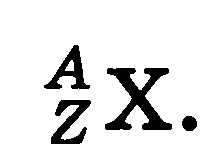
Masa atomului este mai mică decât masa totală a particulelor care compun compoziția.
Defectul de masă este diferența dintre masa totală a particulelor individuale care alcătui atomul (nucleul) și masa totală a atomului (nucleului):
Defectul de masă se datorează eliberării energiei δE în formarea unui atom:
Unitatea de masă atomică (amu) este masa medie a nucleonului în atomul de carbon 12 6 C.
Unitatea de masă atomică este de 1/12 din masa atomului de carbon 12 6 C.
Masa relativă a atomului Mr este numărul de unități atomice de masă conținute în masa atomului:
Mole este cantitatea unei substanțe a cărei masă, exprimată în grame, este egală numeric cu masa relativă a atomului.
Masa molară este masa unui mol.
Unitatea de masă molară este kilogram pe mol (kg / mol). Avogadro constant este numărul de atomi (sau molecule) într-un mol de orice substanță:
Masa moleculară a substanței
Există patru stări agregate (sau faze) ale substanței: plasmă solidă, lichidă, gazoasă.
Faza de tranziție - tranziția sistemului de la o stare agregată la alta. În timpul tranziției de fază
În timpul unui salt, orice cantitate fizică (de exemplu densitatea, energia internă) sau simetria sistemului se modifică. Substanța este în stare solidă, dacă energia potențială medie de atracție a moleculelor este mult mai mare decât energia cinetică medie.
Moleculele într-un solid sunt aranjate într-un mod ordonat.
Se formează o stare lichidă dacă energia potențială medie de atracție a moleculelor este comensurabilă cu energia lor cinetică medie. Aranjamentul ordonat al moleculelor este observat în lichid numai în câteva straturi moleculare învecinate.
Substanța este în stare gazoasă dacă energia cinetică medie a moleculelor depășește energia potențială medie a interacțiunii lor. Moleculele gazului se mișcă haotic. Condiții ideale pentru gaz:
1) diametrul moleculelor este mult mai mic decât distanța medie dintre acestea;
2) energia cinetică medie a moleculelor este mult mai mare decât energia potențială medie a interacțiunii lor;
3) moleculele interacționează una cu alta și cu pereții elastic. Plasma este setul neutru electric de particule neutre și încărcate.
Ionizarea este procesul de formare a ionilor de la atomi.