
Această lecție se desfășoară în clasa a 7-a de către G.E. Рудзитис 8 класс cu aplicarea TIC. În dezvoltarea metodologică este prezentat un plan-rezumat al lecției de aprofundare și actualizare a cunoștințelor, de stabilire a abilităților practice și de prezentare a acesteia. Scop: generalizarea și sistematizarea cunoștințelor despre formulele chimice, compoziția calitativă și cantitativă a substanțelor; să dezvolte abilitățile de rezolvare a problemelor utilizând fracțiunea de masă a unui element din materie, să se familiarizeze cu modalitățile de găsire a formulelor de substanțe din datele privind fracțiile de masă ale unui element.
Având în planul p
în capitolul 7 al rezoluției:
"MASIVE D OOL E L M E N T A A
Tema lecției. Fracțiunea de masă a unui element dintr-o substanță complexă. soluţii
Scopul lecției este generalizarea și sistematizarea cunoștințelor despre formulele chimice,
compoziția calitativă și cantitativă a substanțelor; dezvolta abilitățile
rezolvarea problemelor utilizând fracțiunea de masă a unui element dintr-o substanță; să se familiarizeze cu metodele de găsire a formulelor de substanțe din datele privind fracțiunile de masă ale elementelor.
Echipamente: sistem periodic de elemente chimice ale DI Mendeleev, carduri cu o sarcină pentru lucrul frontal, algoritmi.
Concepte și termeni de bază: formula relativă și greutățile moleculare relative, fracția de masă a unui element, substanțe simple și complexe,
Tipul lecției: aprofundarea și actualizarea cunoștințelor, consolidarea abilităților practice.
Metode și tehnici: explicativ-ilustrativ; practic. rezolvarea problemelor; reproducere; căutare parțial.
I. Stadiul organizațional
II. Verifică-ți temele
III. Actualizarea cunoștințelor de bază ale elevilor
IV. Sinteza și sistematizarea cunoștințelor studenților
V. Temele
VI. Rezumați lecția
"Abilitatea de a rezolva problemele este o artă dobândită prin practică"
1. Etapa organizatorică
II. Verificați temele.
Pentru o ascensiune reușită la vârful cunoștințelor, este necesar să aveți o pregătire bună, să aveți cunoștințele și abilitățile necesare pentru a stăpâni materialul. Să verificăm cât suntem gata să urcăm spre vârf, la percepția noilor cunoștințe. Ce cunoștințe deținem deja și ce trebuie să stăpânim.
Verificarea performanței temelor scrise.
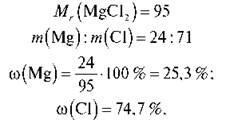
m (Cr). m (O) = 52: 48 = 26:24 = 13: 12
III. Actualizarea cunoștințelor de bază ale elevilor
Treptat începem să ne ridicăm la vârful cunoștințelor. Dar pentru o cale atât de dificilă, trebuie să avem instrumente, adică să ne reamintim câteva informații care vor fi necesare atunci când studiază subiectul.
- Definiți termenul de "masă moleculară relativă". Cum se calculează?
- Dați definiția conceptului de "fracțiune de masă a unui element în materie". Cum se calculează?
- Notați formulele pentru a calcula fracțiunea de masă a elementului și masa elementului.
- Ce cantități trebuie să știți pentru a calcula fracția de masă a unui element prin formula chimică?
- Cum se găsește masa atomică relativă?
- Prin ce date sunt formulate formulele chimice?
IV. Sinteza și sistematizarea cunoștințelor studenților
Înaintea noastră este punctul culminant al cunoașterii. În ultima lecție am învățat deja metodele de bază de rezolvare a problemelor prin formula materiei și fiecare dintre voi a ajuns la unele înălțimi pe acest summit. Cineva se află la poalele muntelui (nivelul de mijloc), care a atins vârful - vârful cunoașterii. Și astăzi trebuie să ne ridicăm cât mai mult posibil, să învățăm cum să găsim fracțiile de masă ale elementelor în substanțe, să calculam masele de elemente prin fracțiile lor de masă și să găsim formulele de substanțe din date privind fracțiile de masă ale elementelor.
Uită-te la alpinist la poalele muntelui. Crezi că are nevoie de un efort de a urca pe munte? Și dacă vă deplasați fără efort pe munte, de unde puteți merge? Așa că astăzi, în lecție, pentru a nu se răsturna, va trebui să depunem multe eforturi pentru a rezolva exercițiile, să fim atenți și perseverenți în muncă.
1. Rezolvarea problemelor folosind conceptul de "fracțiune de masă a unui element"
1. Notați starea scurtă a sarcinii. 2. Determinați masa moleculară sau formula moleculară relativă a substanței. 3. Determinați fracțiunea de masă a elementului dorit de materie prin formula. 4. Scrieți un răspuns.
Pentru a determina fracțiunea de masă a unui element dintr-un compus, utilizați formula:
Unde ω% (E) este fracția de masă a elementului din compus;
n este numărul de atomi ai elementului din compus;
Ar (E) este masa atomică relativă a acestui element;
Mr (substanța) este greutatea moleculară relativă a compusului.
Problema 1. a) Malachitul este un mineral fragil de culoare verde, are formula CuCO3 (OH) 2. El este considerat o piatră rusă, faima sa începând din 1635r. - după descoperirea minelor de malarit Ural, care sunt acum complet epuizate. Determinați fracțiunea de masă a tuturor elementelor din această legătură.
b) Magnezitul are formula MgCO3. Calculați fracțiile de masă ale elementelor din minerale.
c) Emerald este o piatră verde, formula este Be 3 Al2 (SiO3) 6. În ceașcă de smarald, conform legendei biblice, sângele lui Hristos a fost colectat. Împăratul roman Nero a urmărit prin Roma un monoclu de smarald. Determinați fracțiunea de masă a tuturor elementelor din această legătură.
Problema 2. a) Turcoazul are o culoare albastră datorită prezenței ionilor de cupru în acest compus. Este chimic instabil: absoarbe umezeala, absoarbe grasimile, "se teme" de soare, interacționează cu dioxidul de carbon, obținând o culoare verde. O pietricele de 208g conține 16 g de atomi de cupru. Calculați fracția de masă de cupru în turcoaz.
b) Ruby, care în India antică era numită regele pietrelor prețioase - un fel de corund mineral (Al 2 O 3). Culoarea roșie determină adițiile de atomi de crom. Un cristal rubin cântărind 167 g conține 15 g atomi de crom. Calculați fracția de masă a cromului din acest cristal.
2. Calcularea raportului dintre masele de elemente dintr-o substanță complexă în conformitate cu formula sa
1. Notați starea scurtă a sarcinii.
2. Scrieți formulele pentru calculul rapoartelor de masă ale elementelor, indicând simbolurile acestora în paranteze:
m (A). m (B). m (C) = xM (A). yM (B). zM (C)
3. Calculați rapoartele de masă prin înlocuirea valorilor corespunzătoare în formule.
Zadacha1. Găsiți raportul masic al elementelor din sulfatul de aluminiu Al2 (SO4) 3.
Problema 2. Găsiți raportul masic al elementelor din glucoză C 12 H 22 O11
3. Calcularea masei unui element printr-o fracție de masă cunoscută.
1. Notați starea scurtă a problemei
2. Determinați greutatea moleculară relativă a substanței
3. Determinați masa elementului prin formula
4. Înregistrați răspunsul
Sarcina 1. Hematită - o piatră semiprețioasă de la negru la roșu, cunoscută chiar și în Egiptul antic. Fracțiunea de masă a fierului este 0,7. Calculați masa de fier într-o piatră cu o masă de 50 g.
Problema 2. A) Silvina minerală, care are formula chimică KCl, este utilizată ca îngrășământ de potasiu. Se calculează masa atomilor de potasiu, care este conținută în 50 g sylvit.
B) Cristalul roșu este cristalin. transparent, cuarț incolor cu formula chimică SiO2. În Grecia antică sa crezut că aceasta este apă cristalină pietrificată, care și-a pierdut complet căldura. Care este masa siliciului conținut într-un cristal de piatră, cu o masă de 200 g?
4. Calcularea masei de materie printr-o fracție de masă cunoscută a elementului.
Algoritmul 1. Scrieți starea scurtă a problemei
2. Determinați masa moleculară sau formula moleculară relativă a substanței
3. Cunoașterea fracțiunii de masă a elementului și a masei acestuia în substanță, folosind proporția, găsim masa compusului.
Problema 1. Safii de culoare albastră au fost de mult "pietre regale" - simboluri ale înțelepciunii, puterii, victoriei. Acesta este un fel de corindon cu o fracție de masă din aluminiu de 52,9% și impurități de titan și fier. Calculați masa cristalului de safir, care conține 5,4 grame de atomi de aluminiu.
Problema 2. Marmura. calcar, calcit și cretă sunt varietăți ale unui compus cu formula chimică CaCO3. Determinați cât de mult din acest compus conține 120 g de atomi de carbon.
5. Găsirea formulelor de substanțe din datele privind fracțiunile de masă ale elementelor.
1. Vă scriem pe scurt starea problemei.
2. Determinați masa moleculară sau formula relativă
3. Folosind formula n = W • Mr / Ar • 100%, puteți determina numărul de atomi din fiecare element din formula.
4. Înregistrați răspunsul.
Zadacha1. Mineritul de pirită este fierul din care se produce fierul. Acesta conține 47% fier și 53% sulf. Masa relativă a formulei de pirită este 120. Determinați formula de pirită.
Problema 2. Determinați formula hematitului - un compus de fier cu oxigen, în care fracțiunea de masă a fierului este de 70%.
6. Găsirea formulei substanței după rapoartele de masă ale elementelor.
Scriem scurta conditie a problemei.
Scrieți formula pentru calculul raporturilor de masă ale elementelor, indicând simbolurile în paranteze:
m (A). m (B). m (C) = X: Y. Z,
Mergeți la rapoartele de masă, care ar conține un număr întreg de atomi din fiecare specie.
Scrieți formula substanței.
Problema 1. Stabiliți cea mai simplă formulă pentru o substanță care conține hidrogen, carbon, oxigen și azot într-un raport de greutate de 1: 3: 4: 7.
Zadacha2. Raportul de masă dintre cupru, sulf și oxigen este de 2: 1: 2. Se deduce formula substanței.
1. Calculați fracția masică de cupru din compusul CuS04
A) 20; B) 40; B) 60; D) 80
2. Fracțiunea de masă de sodiu din sodă este de 27%. Calculați greutatea
atomi de sodiu într-o sifon cu o masă de 20 g.
A) 6,8; B) 8,2; B) 5,4; D) 3.6
3. Calculați masa de cristal de rock, care conține 80 g de oxigen, dacă fracțiunea de masă a oxigenului din acesta este de 53%.
A) 249; B) 124,5; B) 150,9; D) 265,8
4. Se deduce formula de pirolusit, dacă se știe că manganul și oxigenul cu fracțiuni de masă de 63% și 37% sunt incluse în compoziția sa, iar masa relativă a formulării este 87.
1. Se calculează fracția de masă din aluminiu în compusul AlPO4
A) 22, B) 33, B) 44, D) 66
2. Fracțiunea de masă a fierului în siderit este de 48%. Calculați masa de atomi de fier într-un mineral cu o masă de 200 g.
A) 60; B) 40; B) 96; D) 20
3. Se calculează masa cristalului mineral, care conține 30 g magneziu, dacă fracția de masă a magneziului este de 48%.
A) 67,5; B) 56,8; B) 62,5; D) 34,8
4. Setați formula din cinabru. dacă se știe că mercurul și sulful cu fracțiuni de masă de 86% și 14% sunt incluse în compoziția sa, iar masa relativă a formulării este 233.
Profesor. Fiecare substanță are propria sa caracteristică numai pentru formula sa chimică, care prezintă o compoziție calitativă și cantitativă. Prin formula, puteți numi substanța. În plus, formula își găsește masa relativă a formulării și fracțiunea de masă a elementelor din compus. Un plan poate fi folosit pentru a descrie o substanță utilizând o formulă.
Compoziția calitativă a substanței (elementele care o compun).
Materie complexă sau simplă.
Compoziția cantitativă (numărul atomilor fiecărui element din unitatea de formulă).
Raportul atomilor de elemente diferite în materie.
Masa relativă a formulărilor.
Fracțiunea de masă a elementelor din compus.
Aici suntem pe lângă cunoaștere. Astăzi, fiecare dintre voi a câștigat mica victorie. Să punem steagurile noastre pe aceeași înălțime de cunoaștere pe care am obținut-o în lecție.
Învățarea este o lucrare care începe în școală. dar se termină acasă.
Finalizați sarcina de pe carduri
Găsi și să se pregătească informații pentru prezentarea de pietre prețioase (legende, fapte istorice, impactul asupra sănătății, destin, mascotele)